题目内容
有关碰撞理论,下列说法中不正确的是( )
| A、具有足够能量的分子(活化分子)相互碰撞就一定能发生化学反应 |
| B、增大反应物浓度,单位体积内活化分子数增多,有效碰撞几率增大,反应速率增大 |
| C、升高温度,活化分子百分数增大,有效碰撞的几率增大,反应速率增大 |
| D、正催化剂能降低反应的活化能,提高活化分子百分数,有效碰撞的几率增大,反应速率增大 |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:活化分子发生反应生成新物质的碰撞为有效碰撞,增大浓度、压强,可增大单位体积活化分子数目,升高温度、加入催化剂,可增大活化分子数目,进而增大反应速率,以此解答该题.
解答:
解:A.活化分子发生反应生成新物质的碰撞为有效碰撞,相互碰撞不一定能发生化学反应,取决于碰撞的方向,故A错误;
B.增大反应物浓度,单位体积内活化分子数增多,可增大反应速率,故B正确;
C.升高温度,使活化分子百分数增加,反应速率增大,故C正确;
D.催化剂能降低反应的活化能,提高活化分子百分数,则增大反应速率,故D正确.
故选A.
B.增大反应物浓度,单位体积内活化分子数增多,可增大反应速率,故B正确;
C.升高温度,使活化分子百分数增加,反应速率增大,故C正确;
D.催化剂能降低反应的活化能,提高活化分子百分数,则增大反应速率,故D正确.
故选A.
点评:本题考查温度、浓度、催化剂对反应速率的影响,题目难度不大,注意对活化分子的浓度以及百分数的影响.

练习册系列答案
相关题目
在40GPa高压下,用激光器加热到1 800K时,人们成功制得原子晶体干冰,其结构和性质与SiO2原子晶体相似,下列说法正确的是( )
| A、原子晶体干冰易汽化,可用作制冷剂 |
| B、原子晶体干冰有很高的熔点和沸点 |
| C、原子晶体干冰的硬度小,不能用作耐磨材料 |
| D、1 mol原子晶体干冰中含2 mol C-O键 |
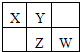 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中不正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中不正确的是( )| A、四种元素的氢化物中,Y的氢化物沸点最高 |
| B、Z的单质不溶于水,有多种同素异形体 |
| C、阴离子的还原性:X<Y |
| D、X的气态氢化物能与其最高价氧化物对应的水化物反应生成盐 |
下列方程式中,正确的是( )
| A、S2-水解反应:S2-+2H2O?H2S+2OH- |
| B、氯气与氯化亚铁溶液反应:Cl2+2Fe2+═2Fe3++2Cl- |
| C、H2CO3在水中电离:H2CO3?2H++CO32- |
| D、氢氧化钠溶液吸收过量的二氧化碳:2NaOH+CO2═Na2CO3+2H2O |
一定条件下a mol CO2通过足量Na2O2,将所得气体与b mol NO混合,得c mol气体.若不考虑NO2的二聚反应,则关于c的判断错误的是( )
| A、若a<b时,c>(a+b) |
| B、若a<b时,c<(a+b) |
| C、若a>b时,c=(a+b) |
| D、若a=b时,c=(a+b) |
利用如图所示装置,能完成实验室制取气体的是( )


| A、用①③制取氧气 |
| B、用②③制取二氧化碳 |
| C、用②④制取氧气 |
| D、用①⑤制取二氧化碳 |
将3mol 甲烷与氯气发生取代反应,待反应完全后测知四种取代物的物质的量相同,测消耗的氯气有( )
| A、2mol | B、10mol |
| C、7.5mol | D、6mol |
PbO2微热时会分解成PbO和O2,PbO是一种不溶于水但易溶于酸的黄色物质.把适量的黑褐色PbO2粉末投入热水,一边搅拌,一边通入SO2气体,结果得到白色不溶物.下列判断中错误的是( )
| A、PbO2具有氧化性 |
| B、白色不溶物为PbSO3 |
| C、白色不溶物为PbSO4 |
| D、白色不溶物既是氧化产物又是还原产物 |