题目内容
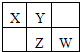 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中不正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中不正确的是( )| A、四种元素的氢化物中,Y的氢化物沸点最高 |
| B、Z的单质不溶于水,有多种同素异形体 |
| C、阴离子的还原性:X<Y |
| D、X的气态氢化物能与其最高价氧化物对应的水化物反应生成盐 |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由短周期元素X、Y、Z、W在元素周期表中的位置,可知X、Y处于第二周期,Z、W处于第三周期,Y原子的最外层电子数是次外层电子数的3倍,最外层电子数为6,故Y为O元素,可推知X为N元素、Z为S元素、W为Cl,据此解答.
解答:
解:由短周期元素X、Y、Z、W在元素周期表中的位置,可知X、Y处于第二周期,Z、W处于第三周期,Y原子的最外层电子数是次外层电子数的3倍,最外层电子数为6,故Y为O元素,可推知X为N元素、Z为S元素、W为Cl,
A.四种元素的氢化物中,水分子之间存在氢键,常温下为液态,其它为气体,故水的沸点最高,故A正确;
B.单质硫不溶于水,存在S2、S4、S8等多种同素异形体,故B正确;
C.非金属性X<Y,阴离子的还原性:X>Y,故C错误;
D.氨气与硝酸反应生成硝酸铵,故D正确,
故选C.
A.四种元素的氢化物中,水分子之间存在氢键,常温下为液态,其它为气体,故水的沸点最高,故A正确;
B.单质硫不溶于水,存在S2、S4、S8等多种同素异形体,故B正确;
C.非金属性X<Y,阴离子的还原性:X>Y,故C错误;
D.氨气与硝酸反应生成硝酸铵,故D正确,
故选C.
点评:本题考查结构性质位置关系应用,难度不大,推断元素是解题关键,注意对基础知识的理解掌握.

练习册系列答案
相关题目
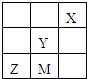 四种非金属主族元素M、X、Y、Z在周期表中相对位置如图,下列判断不正确的是( )
四种非金属主族元素M、X、Y、Z在周期表中相对位置如图,下列判断不正确的是( )| A、Z的氢化物中中心原子的杂化方式为sp3 |
| B、Z原子的第一电离能小于M原子的第一电离能 |
| C、四种元素全部位于p区 |
| D、M、Y、Z最高价氧化物对应水化物的酸性从强到弱的顺序为:Y>M>Z |
下列说法正确的是( )
| A、进行纸层析操作时,要让层析试纸上的点样点进入展开剂,进行展开 |
| B、在酸性K2Cr2O7溶液中滴加亚硝酸钠溶液,溶液会变绿色 |
| C、乙酸和乙醇的混合液可用分夜漏斗进行分离 |
| D、用盐酸标准液滴定待测的氢氧化钠时,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低 |
天然气、石油、煤等在地球上的蕴藏量是有限的,下列说法正确的是( )
①可砍伐树木、野草作能源
②可用酒精作能源
③可利用电解水的方法制得氢气作能源
④应开发太阳能、核能等新能源
⑤大量应用风能、水能等可再生能源.
①可砍伐树木、野草作能源
②可用酒精作能源
③可利用电解水的方法制得氢气作能源
④应开发太阳能、核能等新能源
⑤大量应用风能、水能等可再生能源.
| A、①③ | B、①⑤ |
| C、②③④ | D、②④⑤ |
配置一定体积、一定物质的量浓度的NaOH溶液,下列情况对实验结果产生偏低影响的是( )
| A、容量瓶中原有少量水 |
| B、溶解所用的烧杯未洗涤 |
| C、定容时俯视 |
| D、溶解后立即注入容量瓶中 |
有关碰撞理论,下列说法中不正确的是( )
| A、具有足够能量的分子(活化分子)相互碰撞就一定能发生化学反应 |
| B、增大反应物浓度,单位体积内活化分子数增多,有效碰撞几率增大,反应速率增大 |
| C、升高温度,活化分子百分数增大,有效碰撞的几率增大,反应速率增大 |
| D、正催化剂能降低反应的活化能,提高活化分子百分数,有效碰撞的几率增大,反应速率增大 |
萃取水中的溴,不可以选择的萃取剂是( )
| A、汽油 | B、酒精 | C、苯 | D、四氯化碳 |
要配制浓度约为2mol?L-1NaOH溶液100mL,下面操作正确的是( )
| A、称取8gNaOH固体,放入100mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解 |
| B、称取8gNaOH固体,放入100mL量筒中,边搅拌,便慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL |
| C、称取8gNaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加水到刻度,盖好瓶塞,反复摇匀 |
| D、用100mL量筒量取40mL5mol?L-1NaOH溶液,倒入250mL烧杯中,再用同一量筒取60mL蒸馏水,不断搅拌下,慢慢倒入烧杯 |
 化学反应产生的各种能量是人类探索太空所需能量的重要来源.
化学反应产生的各种能量是人类探索太空所需能量的重要来源.