题目内容
17.下列叙述中不正确的是( )| A. | 向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaOH饱和溶液,又有CaCO3沉淀生成 | |
| B. | 向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1:2 | |
| C. | 等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积前者多 | |
| D. | 向Na2CO3饱和溶液中通CO2,有NaHCO3结晶析出 |
分析 A.含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,生成Ca(HCO3)2,加入NaOH饱和溶液,可生成碳酸钙沉淀;
B.向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成NaHCO3;
C.NaHCO3的摩尔质量比Na2CO3小,以此计算;
D.向Na2CO3饱和溶液中通CO2,生成溶解度更小的NaHCO3.
解答 解:A.含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,发生CaCO3+CO2+H2O=Ca(HCO3)2,生成Ca(HCO3)2,加入NaOH饱和溶液,可生成碳酸钙沉淀和碳酸钠,故A正确;
B.根据化学方程式:Na2CO3+HCl=NaCl+NaHCO3,当碳酸钠和盐酸物质的量相等时,不会产生二氧化碳,故B错误;
C.NaHCO3和Na2CO3都与盐酸反应生成二氧化碳气体:Na2CO3+2HCl=2NaCl+H2O+CO2↑,NaHCO3+HCl=NaCl+H2O+CO2↑,NaHCO3的摩尔质量比Na2CO3小,则生成的CO2体积前者多,故C正确;
D.向Na2CO3饱和溶液中通CO2,生成溶解度更小的NaHCO3,可析出NaHCO3晶体,故D正确.
故选B.
点评 本题考查难溶电解质的溶解平衡以及盐类的水解,侧重考查Na2CO3和NaHCO3性质的异同,题目难度不大,注意把握Na2CO3和NaHCO3性质,注重基础知识的积累.

练习册系列答案
相关题目
15.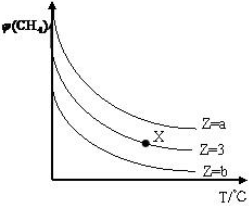 一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)设起始$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示,下列说法错误的是( )
一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)设起始$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示,下列说法错误的是( )
 一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)设起始$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示,下列说法错误的是( )
一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)设起始$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示,下列说法错误的是( )| A. | 该反应的焓变△H>0 | |
| B. | 图中Z的大小为b>3>a | |
| C. | 图中X点对应的平衡混合物中$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=3 | |
| D. | 温度不变时,图中X点对应的平衡在加压后φ(CH4)增大 |
5.下列关于硬水及其软化的说法正确的是( )
| A. | 软水是不含Ca2+、Mg2+的水 | |
| B. | 石灰-纯碱法中石灰是指CaCO3 | |
| C. | 石灰-纯碱法软化硬水过程中,Mg2+引起的硬度转化成了Ca2+的硬度 | |
| D. | 离子交换剂不能再生 |
12.下图是侯氏制碱法在实验室进行模拟实验的生产流程示意图,下列叙述错误的是( )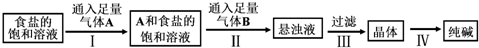
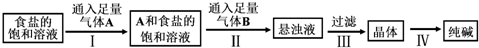
| A. | 气体A是NH3,气体B是CO2 | |
| B. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| C. | 第III步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒 | |
| D. | 第Ⅳ步操作的主要过程有溶解、蒸发、结晶 |
2.已知常温下:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12,下列叙述正确的是( )
| A. | AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小 | |
| B. | 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说Ksp(AgCl)<Ksp(AgBr) | |
| C. | 将0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液中先产生Ag2CrO4沉淀 | |
| D. | 向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 |
6.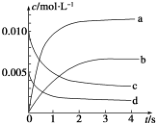 在 2L 容积不变的密闭容器内,800℃时反应 2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:
在 2L 容积不变的密闭容器内,800℃时反应 2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:
(1)用O2的反应速率表示 0~2s 内该反应的平均反应速率 v=1.5×10-3mol•L-1•s-1.若上述反应在850℃下进行,反应2s时 n(NO)=0.009mol,并且不再随时间而改变,则该反应是放热反应.
(2)图中表示NO2浓度变化的曲线是b(填字母).
(3)能说明该反应已达到平衡状态的是BC(填序号).
A.v(NO2)=2v(O2)
B.容器内的压强保持不变
C.v逆(NO)=2v正(O2)
D.容器内气体密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是C(填序号).
A.及时分离出NO2
B.适当升高温度
C.增大O2的浓度
D.选择高效催化剂.
 在 2L 容积不变的密闭容器内,800℃时反应 2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:
在 2L 容积不变的密闭容器内,800℃时反应 2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:| t/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示NO2浓度变化的曲线是b(填字母).
(3)能说明该反应已达到平衡状态的是BC(填序号).
A.v(NO2)=2v(O2)
B.容器内的压强保持不变
C.v逆(NO)=2v正(O2)
D.容器内气体密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是C(填序号).
A.及时分离出NO2
B.适当升高温度
C.增大O2的浓度
D.选择高效催化剂.
7.下列状态的物质,既能导电又属于电解质的是( )
| A. | 液态氯化氢 | B. | NaCl晶体 | C. | 熔融的KNO3 | D. | CuSO4溶液 |