题目内容
14. 从海带中提取单质碘及碘的化合物间的转化关系如图所示:
从海带中提取单质碘及碘的化合物间的转化关系如图所示:请按要求回答下列问题:
(1)从海带灰浸取液中提取单质碘涉及的反应 ①,所用试剂是MnO2、稀硫酸,其离子方程式是MnO2+4H++2I-=Mn2++I2+2H2O;实现反应①还可以选用的试剂有(填字母序号)ab.
a.3%的H2O2、稀硫酸 b.氯水 c.FeCl2溶液 d.NaOH溶液
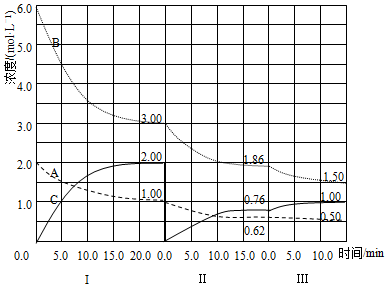
(2)反应②2HI(g)?H2(g)+I2(g) 的能量变化如图1所示;其他条件相同,1mol HI 在不同温度分解达平衡时,测得体系中n(I2)随温度变化的曲线如图2所示.

i.比较 2z>(x+y)(填“<”、“>”或“=”),理由是根据图2知,升高温度平衡正向移动,该反应正反应为吸热反应,2HI(g)?H2(g)+I2(g),△H>0,△H=2z-(x+y)>0,所以2z>x+y
ii.某温度下该反应的平衡常数=$\frac{1}{64}$,达平衡时,HI 的转化率=20%.
iii.只改变该反应的一个条件,能提高 HI 转化率的措施是(填字母序号)cd.
a.增大HI 浓度 b.加压 c.移走I2 d.升温
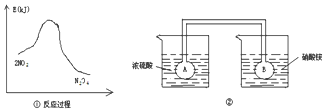
(3)反应=③在碱性条件下I2可以转化为IO3-.电解KI溶液制备KIO3的工作原理如下图所示.电解过程中观察到阳极液变蓝,一段时间后又逐渐变浅.
i.M连接电源的正极.
ii.结合实验现象和电极反应式说明制备KIO3的原理:I-在阳极失电子生成I2,使阳极溶液变蓝色,OH-通过阴离子交换膜移向阳极,在阳极室I2与OH-反应2I2+6OH-=5I-+IO3-+3H2O,使阳极区域蓝色变浅,并获得产品KIO3.
分析 (1)MnO2具有氧化性、碘离子具有还原性,酸性条件下,MnO2和碘离子发生氧化还原反应生成碘和水;将I-氧化成I2的试剂可选双氧水和氯水;
(2)i.根据图2知,升高温度碘含量增大,说明HI的分解反应是吸热反应,则2molHI分解吸收的能量大于1mol碘和1mol氢气分解吸收的能量;
ii.化学平衡常数K=$\frac{c({I}_{2})•c({H}_{2})}{{c}^{2}(HI)}$;
iii.能提高HI 转化率的措施降低生成物浓度、升高温度;
(3)根据图知,发现a极变蓝,则a电极上碘离子转化为碘,a为阳极,b为阴极;
i.连接电源正极的为阳极;
ii.碱性条件下碘被氧化生成碘酸根离子.
解答 解:(1)MnO2具有氧化性、碘离子具有还原性,酸性条件下,MnO2和碘离子发生氧化还原反应生成碘和水,离子方程式为MnO2+4H++2I-=Mn2++I2+2H2O;将I-氧化成I2的试剂可选双氧水和氯水;
故答案为:MnO2+4H++2I-=Mn2++I2+2H2O;ab;
(2)i.根据图2知,升高温度平衡正向移动,该反应正反应为吸热反应,2HI(g)?H2(g)+I2(g),△H>0,△H=2z-(x+y)>0,所以2z>x+y,
故答案为:>;根据图2知,升高温度平衡正向移动,该反应正反应为吸热反应,2HI(g)?H2(g)+I2(g),△H>0,△H=2z-(x+y)>0,所以2z>x+y;
ii.化学平衡常数K=$\frac{c({I}_{2})•c({H}_{2})}{{c}^{2}(HI)}$,因碘和氢气的计量数相等,则K=$\frac{c({I}_{2})•c({H}_{2})}{{c}^{2}(HI)}$=$\frac{{c}^{2}({H}_{2})}{{c}^{2}(HI)}$=$\frac{1}{64}$,所以$\frac{c({H}_{2})}{c(HI)}$=$\frac{1}{8}$,设平衡时氢气浓度是xmol/L、HI浓度是8xmol/L,生成的碘是参加反应的HI的2倍,则参加反应的HI浓度是2xmol/L,所以HI转化率=$\frac{2xmol/L}{(2x+8x)mol/L}$×100%=20%,
故答案为:20%;
iii.a.增大HI 浓度平衡正向移动,但HI浓度增大量远远大于HI转化浓度,所以HI转化率降低,故a错误;
b.该反应前后气体计量数之和不变,所以加压平衡不移动,不能提高HI转化率,故b错误;
c.移走I2,平衡正向移动,则提高HI转化率,故c正确;
d.该反应的正反应是吸热反应,升温平衡正向移动,HI转化率提高,故d正确;
故答案为:cd;
(3)根据图知,发现a极变蓝,则a电极上碘离子转化为碘,a为阳极,b为阴极;
i.连接电源正极的为阳极,所以a连接电源正极,
故答案为:正;
ii.I-在阳极失电子生成I2,使阳极溶液变蓝色,OH-通过阴离子交换膜移向阳极,在阳极室I2与OH-反应2I2+6OH-=5I-+IO3-+3H2O,使阳极区域蓝色变浅,
故答案为:I-在阳极失电子生成I2,使阳极溶液变蓝色,OH-通过阴离子交换膜移向阳极,在阳极室I2与OH-反应2I2+6OH-=5I-+IO3-+3H2O,使阳极区域蓝色变浅,并获得产品KIO3.
点评 本题考查较综合,涉及化学平衡计算、电解原理、反应热的计算等知识点,侧重考查学生分析判断、获取信息解答问题及计算能力,注意(2)③中d选项,很多同学往往认为“增大反应物浓度平衡正向移动则一定增大其转化率”而导致错误,为易错点.

 优生乐园系列答案
优生乐园系列答案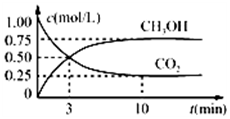 在体积为1L的恒温密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
在体积为1L的恒温密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )| A. | 该化学反应在3 min时达到平衡状态 | |
| B. | 保持其他条件不变,降低温度,平衡时c(CH3OH)=0.85 mol•L-1,则该反应放热 | |
| C. | 若相同温度下,上述容器容积可变,保持容器内压强不变,同样向容器中充入1 molCO2、3mol H2,则平衡时CO2的浓度与图中相同 | |
| D. | 12 min时,向上述容器中再充入0.25 mol CO2、0.25 mol H2O(g),此时反应将向逆反应方向进行 |
(1)肼易溶于水,性质与氨相似,用电离方程式表示肼的水溶液显碱性的原因N2H4+H2O?N2H+5+OH-.
(2)肼(N2H4)与N2O4的反应为:2N2H4 (1)+N2O4 (1)=3N2(g)+4H2O(1)△H=-1225kJ•mol-1
已知反应相关的化学键键能数据如下:
| 化学键 | N-H | N-N | N≡N | O-H |
| E/(kJ•mol-1) | 390 | 190 | 946 | 460 |
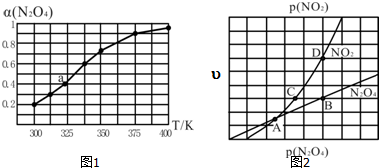
(3)N2O4与NO2之间存在反应N2O4(g)═2NO2(g).将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图1所示.
①由图推测该反应△H>0(填“>”或“<”),理由为温度升高,α(N2O4)增加,说明平衡右移,该反应为吸热反应,△H>0,若要提高N2O4的转化率,除改变反应温度外,其他措施有减小体系压强(或移出NO2等)(要求写出一条).
②图中a点对应温度下,已知N2O4的起始压强p0为108kPa,列式计算该温度下反应的平衡常数Kp=115.2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
③在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系:υ(N2O4)=k1p(N2O4),υ(NO2)=k2p2(NO2),其中kl、k2是与反应温度有关的常数.相应的速率一压强关系如图2所示,一定温度下,kl、k2与平衡常数Kp的关系是kl=$\frac{1}{2}$K2.Kp,在图标出的点中,能表示反应达到平衡状态的点为B点与D点,理由是满足平衡条件υ(NO2)=2υ(N2O4).
| A. | 杂化轨道的数目、形状和参与杂化的原子轨道数目、形状均相同 | |
| B. | 等性杂化轨道的形状、能量相等; NH3中N是等性杂化 | |
| C. | 各杂化轨道在空间应满足电子对互斥理论,以使排斥力最小 | |
| D. | sp3杂化轨道应由同原子里能量相同的s和p轨道杂化而得 |
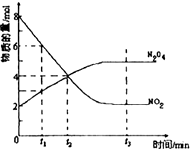 一定温度下,在容积为1L的密闭容器中放入2molN2O4和8molNO2,发生如下反应2NO2(红棕色)═N2O4(无色)△H<0反应中NO2、N2O4的物质的量随反应时间变化的曲线如图,按下列要求作答:
一定温度下,在容积为1L的密闭容器中放入2molN2O4和8molNO2,发生如下反应2NO2(红棕色)═N2O4(无色)△H<0反应中NO2、N2O4的物质的量随反应时间变化的曲线如图,按下列要求作答: 反应类型加聚反应
反应类型加聚反应 反应类型取代反应
反应类型取代反应 反应类型取代反应
反应类型取代反应