题目内容
19.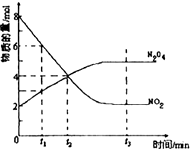 一定温度下,在容积为1L的密闭容器中放入2molN2O4和8molNO2,发生如下反应2NO2(红棕色)═N2O4(无色)△H<0反应中NO2、N2O4的物质的量随反应时间变化的曲线如图,按下列要求作答:
一定温度下,在容积为1L的密闭容器中放入2molN2O4和8molNO2,发生如下反应2NO2(红棕色)═N2O4(无色)△H<0反应中NO2、N2O4的物质的量随反应时间变化的曲线如图,按下列要求作答:(1)在该温度下,反应的化学平衡常数表达式为:K=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$.
(2)若t1=10s,t2=30s,计算从t1至t2时以N2O4表示的反应速率:0.05mol•L-1•s-1.
(3)图中t1、t2、t3哪一个时刻表示反应已经达到平衡?答:t3.
(4)t1时,正反应速率>(填“>”、“<”或“=”)逆反应速率.
(5)维持容器的温度不变,若缩小容器的体积,则平衡向正反应方向移动(填“正反应方向”、“逆反应方向”或“不变”)
(6)维持容器的体积不变,升高温度,达到新平衡时体系的颜色变深(填“变深”、“变浅”或“不变”).
分析 (1)K为生成物浓度幂之积与反应物浓度幂之积的比;
(2)结合v=$\frac{△c}{△t}$计算;
(3)物质的量不变时为平衡状态;
(4)t1时,反应物的物质的量仍在减小;
(5)持容器的温度不变,若缩小容器的体积,压强增大,平衡向气体体积减小的方向移动;
(6)2NO2(红棕色)═N2O4(无色)△H<0,为放热反应,升高温度,平衡逆向移动.
解答 解:(1)由反应可知K=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$,故答案为:K=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$;
(2)若t1=10s,t2=30s,从t1至t2时以N2O4表示的反应速率为$\frac{\frac{4mol-3mol}{1L}}{20s}$=0.05 mol•L-1•s-1,故答案为:0.05;
(3)物质的量不变时为平衡状态,只有t3为平衡状态,故答案为:t3;
(4)t1时,反应物的物质的量仍在减小,向正反应方向移动,则正反应速率>逆反应速率,故答案为:>;
(5)持容器的温度不变,若缩小容器的体积,压强增大,平衡向气体体积减小的方向移动,即反应向正反应方向移动,故答案为:正反应方向;
(6)2NO2(红棕色)═N2O4(无色)△H<0,为放热反应,升高温度,平衡逆向移动,则达到新平衡时体系的颜色变深,故答案为:变深.
点评 本题考查化学平衡的计算,为高频考点,把握平衡常数的表达式、速率计算及平衡移动为解答的关键,侧重分析与应用能力的考查,注意判断平衡点,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.下列有关物质用途叙述不正确的是( )
| A. | 从环境保护角度,氟氯代烷不宜用作制冷剂 | |
| B. | 聚氯乙烯制品适宜用于直接盛装食物 | |
| C. | 苯、甲苯、二甲苯都是基本的有机化工原料 | |
| D. | 乙烯用作果实催熟剂 |
9.25℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)H2S的一级电离常数表达式为Ka1=Ka1=$\frac{c({H}^{+}).c(H{S}^{-})}{c({H}_{2}S)}$
(2)CH3COOH、H2C2O4、H2S的酸性由强到弱的顺序H2C2O4>CH3COOH>H2S
(3)H2C2O4与少量的KOH溶液反应的化学方程式:H2C2O4+KOH═KHC2O4+H2O
(4)NaHS溶液与NaHC2O4溶液反应的离子方程式:HS-+HC2O4-═H2S+C2O42-
(5)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是③④ (填写序号).
①反应所需要的时间B>A
②开始反应时的速率A>B
③参加反应的锌的物质的量A=B
④反应过程的平均速率B>A
⑤B中有锌剩余.
| 化学式 | CH3COOH | H2C2O4 | H2S |
| 电离平衡常数 | 1.8×10-5 | Ka1=5.4×10-2 Ka2=5.4×10-5 | Ka1=1.3×10-7 Ka2=7.1×10-15 |
(1)H2S的一级电离常数表达式为Ka1=Ka1=$\frac{c({H}^{+}).c(H{S}^{-})}{c({H}_{2}S)}$
(2)CH3COOH、H2C2O4、H2S的酸性由强到弱的顺序H2C2O4>CH3COOH>H2S
(3)H2C2O4与少量的KOH溶液反应的化学方程式:H2C2O4+KOH═KHC2O4+H2O
(4)NaHS溶液与NaHC2O4溶液反应的离子方程式:HS-+HC2O4-═H2S+C2O42-
(5)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是③④ (填写序号).
①反应所需要的时间B>A
②开始反应时的速率A>B
③参加反应的锌的物质的量A=B
④反应过程的平均速率B>A
⑤B中有锌剩余.

 从海带中提取单质碘及碘的化合物间的转化关系如图所示:
从海带中提取单质碘及碘的化合物间的转化关系如图所示: