题目内容
2.发展洁净煤技术、利用CO2制备清洁能源等都是实现减碳排放的重要途径.(1)将煤转化成水煤气的反应:C(s)+H2O(g)?CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中加入催化剂(其他条件保持不变),此反应的△H不变(填“增大”、“减小”或“不变”),判断的理由是加入催化剂后反应物和生成物的总能量不变.
(2)CO2制备甲醇:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,测得CO2(g) 和CH3OH(g) 浓度随时间变化如图1所示.
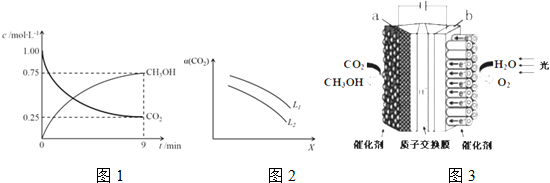
①该反应化学平衡常数K的表达式是$\frac{c({H}_{2}O)•c(C{H}_{3}OH)}{c(CO){c}^{3}({H}_{2})}$.
②0~9min时间内,该反应的平均反应速率ν(H2)=0.25mol/L•min.
③在相同条件下,密闭容器的体积缩小至0.5L时,此反应达平衡时放出的热量(Q)可能是c(填字母序号)kJ.
a.0<Q<29.5 b.29.5<Q<36.75 c.36.75<Q<49 d.49<Q<98
④在一定条件下,体系中CO2的平衡转化率(α)与L和X的关系如图2所示,L和X 分别表示温度或压强.
i.X表示的物理量是温度.
ii.判断L1与L2的大小关系,并简述理由:L1>L2.温度一定时,增大压强,CO2平衡转化率增大.
(3)利用铜基催化剂光照条件下由CO2和H2O制备CH3OH的装置示意图如图3所示,该装置工作时H+移向a极(填“a”或“b”),阴极的电极反应式是CO2+6H++6e-=CH3OH+H2O.
分析 (1)催化剂改变反应速率不改变化学平衡;
(2)①平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
②图象读取甲醇生成浓度,结合反应速率概念计算甲醇的反应速率,依据反应速率之比等于化学方程式计量数之比得到氢气反应速率;
③反应焓变是指1mol二氧化碳和3mol氢气完全反应放出的热量为49KJ,反应是可逆反应,在体积为1L的密闭容器中,充入1molCO2和3molH2,反应放热一定小于49KJ,结合图象中二氧化碳转化率计算此时达到平衡放出的热量,在相同条件下,密闭容器的体积缩小至0.5L时,压强增大,平衡正向进行,反应放出热量会增多;
④反应是气体体积减小的放热反应,升温平衡逆向进行,增大压强平衡正向进行,据此分析图象确定表示的物理量;
(3)电解池中,阳离子移向阴极,该装置工作时阴极发生还原反应,电极反应式为:CO2+6H++6e-=CH3OH+H2O.
解答 解:(1)将煤转化成水煤气的反应:C(s)+H2O?CO2(g)+H2(g)可有效提高能源利用率,若在上述反应体系中加入催化剂(其他条件保持不变),催化剂改变反应速率不改变化学平衡,不改变反应焓变,此反应的△H不变,加入催化剂后反应物和生成物的总能量不变
故答案为:不变;加入催化剂后反应物和生成物的总能量不变;
(2)①CO2(g)+3H2(g)?CH3OH(g)+H2O(g),反应的平衡常数表达式为:K=$\frac{c({H}_{2}O)•c(C{H}_{3}OH)}{c(CO){c}^{3}({H}_{2})}$,
故答案为:$\frac{c({H}_{2}O)•c(C{H}_{3}OH)}{c(CO){c}^{3}({H}_{2})}$;
②图象读取甲醇生成浓度,结合反应速率概念计算甲醇的反应速率=$\frac{0.75mol/L}{9min}$,反应速率之比等于化学方程式计量数之比,V(H2)=3V(CH3OH(g)=3×$\frac{0.75mol/L}{9min}$=0.25mol/L•min,
故答案为:0.25mol/L•min;
③CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,反应达到平衡状态消耗二氧化碳物质的量浓度=1mol/L-0.25mol/L=0.75mol/L,物质的量为0.75mol,反应放出热量=49KJ/mol×0.75mol=36.75KJ,反应焓变是指1mol二氧化碳和3mol氢气完全反应放出的热量为49KJ,反应是可逆反应,在体积为1L的密闭容器中,充入1molCO2和3molH2,反应放热一定小于49KJ,在相同条件下,密闭容器的体积缩小至0.5L时,压强增大,平衡正向进行,反应放出热量会增多,大于36.75KJ,则36.75<Q<49,
故答案为:c;
④CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,反应是气体体积减小的放热反应,
i.温度升高,平衡逆向进行,二氧化碳转化率减小,所以X为温度,L为压强,
故答案为:温度;
ii.温度一定压强增大平衡正向进行二氧化碳转化率增大,所以L1>L2,
故答案为:L1>L2,温度一定时,增大压强,CO2平衡转化率增大
(3)电解池中,该装置工作时H+移向阴极(a),该装置工作时阴极发生还原反应,电极反应式为:CO2+6H++6e-=CH3OH+H2O,
故答案为:a;CO2+6H++6e-=CH3OH+H2O.
点评 本题考查了化学反应速率计算、平衡影响因素分析、平衡常数表示式、图象的理解应用,主要是化学平衡移动原理的分析判断,题目难度中等.

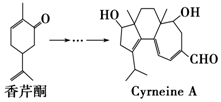 CyrneineA对治疗神经系统疾病有着很好的疗效,制备CyrneineA可用香芹酮经过多步反应合成:下列说法不正确的是( )
CyrneineA对治疗神经系统疾病有着很好的疗效,制备CyrneineA可用香芹酮经过多步反应合成:下列说法不正确的是( )| A. | 香芹酮化学式为C10H14O | |
| B. | CyrneineA可以发生加成反应、消去反应和氧化反应 | |
| C. | 香芹酮和CyrneineA均能使酸性KMnO4溶液褪色 | |
| D. | 与香芹酮互为同分异构体,分子中有4种不同化学环境的氢原子的酚类化合物共有4种 |
| A. | ①③④ | B. | ①②④ | C. | ①②③④ | D. | ①②③⑤ |
| A. | 从环境保护角度,氟氯代烷不宜用作制冷剂 | |
| B. | 聚氯乙烯制品适宜用于直接盛装食物 | |
| C. | 苯、甲苯、二甲苯都是基本的有机化工原料 | |
| D. | 乙烯用作果实催熟剂 |
(1)2P+5CuSO4+8H2O═5Cu+2H3PO4+5H2SO4
(2)11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4
下列有关说法中错误的是( )
| A. | 上述两个反应中,水既不是氧化剂也不是还原剂 | |
| B. | 上述两个反应中,氧化产物都是H3PO4 | |
| C. | 反应(2)中,1mol CuSO4可氧化1/5molP | |
| D. | 上述两个反应中,氧化剂都只有硫酸铜 |

 从海带中提取单质碘及碘的化合物间的转化关系如图所示:
从海带中提取单质碘及碘的化合物间的转化关系如图所示: