题目内容
6.据有关资料,肉的pH值与肉的新鲜度的关系如表:| 新鲜肉 | 次鲜肉 | 变质肉 | |
| pH | 5.8-6.2 | 6.3-6.6 | 6.7以上 |
| A. | 不变 | B. | 变强 | C. | 变弱 | D. | 无法确定 |
分析 当溶液的pH等于7时,呈中性.当溶液的pH大于7时,呈碱性.当溶液的pH<7时,随着pH的减小酸性增强.当溶液的pH小于7时,呈酸性,随着pH的减小酸性增强.
解答 解:新鲜肉在变质过程中pH逐渐升高,酸性逐渐变弱.
故选C.
点评 本题考查了溶液PH变化,解答本题要掌握溶液的酸碱性和溶液pH大小之间的关系,然后再根据具体物质的水溶液的酸碱性进行分析、判断,从而得出正确的结论,题目较简单.

练习册系列答案
相关题目
16.下面的排序正确的是( )
| A. | 晶体熔点由低到高:CCl4<CBr4<CI4<CF4 | |
| B. | 硬度由大到小:金刚石>晶体硅>碳化硅 | |
| C. | 熔点由高到低:Na>Mg>Al | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
17.化学与人类社会的生产、生活有着密切联系,下列说法正确的是( )
| A. | 误食重金属盐引起人体中毒,可喝大量的食盐水解毒 | |
| B. | 石油的分馏、煤的干馏、石油的裂解都是化学变化 | |
| C. | 陶瓷、砖瓦、玻璃、水泥等,都是硅酸盐产品 | |
| D. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 |
14.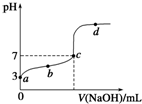 在某温度下,向20mL 0.1mol/L 某一元酸HA溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中一定正确的是( )
在某温度下,向20mL 0.1mol/L 某一元酸HA溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中一定正确的是( )
 在某温度下,向20mL 0.1mol/L 某一元酸HA溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中一定正确的是( )
在某温度下,向20mL 0.1mol/L 某一元酸HA溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中一定正确的是( )| A. | a点表示溶液中c(A-)为0.1 mol/L | |
| B. | a、b、c、d点表示的溶液中一定有:c(H+)•c(OH-)=1×10-14 | |
| C. | c点表示HA和NaOH恰好反应完全 | |
| D. | b、d点表示的溶液中,其$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$值一定不变 |
18.不能由醛加氢还原制得的醇是( )
| A. | CH3CH2CH2CH2OH | B. | CH3CH2OH | ||
| C. |  | D. |  |
10.钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质).
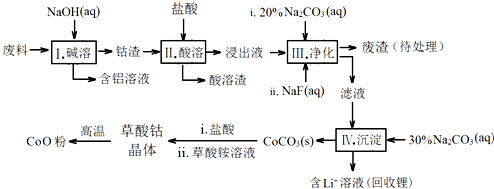
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见表:
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)写出步骤Ⅱ中Co2O3与盐酸反应的离子方程式Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15.废渣中的成分有LiF,Fe(OH)3.
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀.
(5)在空气中加热CoC2O4固体,经测定,210~290℃的过程中只产生CO2和一种化合物,该化合物中钴元素的质量分数为73.44%.此过程发生反应的化学方程式是3CoC2O4+2O2$\frac{\underline{\;210-290℃\;}}{\;}$ Co3O4+6CO2.
(6)某锂离子电池的总反应为C+LiCoO2$?_{放电}^{充电}$ LixC+Li1-xCoO2,LixC中Li的化合价为0价,该锂离子电池充电时阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+xLi+.

已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见表:
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)写出步骤Ⅱ中Co2O3与盐酸反应的离子方程式Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15.废渣中的成分有LiF,Fe(OH)3.
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀.
(5)在空气中加热CoC2O4固体,经测定,210~290℃的过程中只产生CO2和一种化合物,该化合物中钴元素的质量分数为73.44%.此过程发生反应的化学方程式是3CoC2O4+2O2$\frac{\underline{\;210-290℃\;}}{\;}$ Co3O4+6CO2.
(6)某锂离子电池的总反应为C+LiCoO2$?_{放电}^{充电}$ LixC+Li1-xCoO2,LixC中Li的化合价为0价,该锂离子电池充电时阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+xLi+.
 ;NH3:3H•+
;NH3:3H•+ →
→ ;Na2S:
;Na2S: .
.