题目内容
11.用电子式表示下列化合物的形成过程:CaF2:
 ;NH3:3H•+
;NH3:3H•+ →
→ ;Na2S:
;Na2S: .
.
分析 氟化钙为离子化合物,钙离子与两个氟离子通过离子键结合,阴阳离子需要标出所带电荷;
氨气为共价化合物,氮原子与三个氢原子分别共用1对电子,氮原子最外层达到8电子稳定结构;
硫化钠为离子化合物,两个钠离子与硫离子通过离子键结合,阴阳离子需要标出所带电荷.
解答 解:氟化钙为离子化合物,阴阳离子需要标出所带电荷,用电子式表示其形成过程为: ;
;
氨气为共价化合物,分子中存在3个氮氢键,其形成过程为:3H•+ →
→ ,
,
硫化钠是硫离子和钠离子之间通过离子键形成的离子化合物,形成过程为: ,
,
故答案为: ;3H•+
;3H•+ →
→ ;
; .
.
点评 本题考查了用电子式表示化合物的形成过程,明确物质所含化学键类型、电子式的书写方法为解答关键,注意掌握离子化合物与共价化合物的电子式的区别,题目难度中等,

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
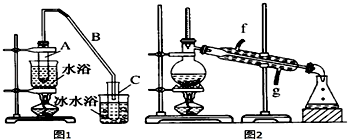
1.某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇制备环己烯.
已知:
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝.
②试管C置于冰水浴中的目的是进一步冷却,防止环己烯挥发.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上层(填“上”或“下”),分液后用c(填选项字母)洗涤.
a.KMnO4溶液 b.稀硫酸 c.Na2CO3溶液
②再将环己烯按如图2装置蒸馏,冷却水从g口进入.蒸馏时要加入生石灰,目的是除去了残留的水.
③收集产品时,控制的温度应在83℃左右,实验制得的环己烯精品质量低于理论产量,可能的原因是c(填选项字母).
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是bd(填选项字母).
a.用酸性高锰酸钾溶液 b.用金属钠 c.用溴水 d.测定沸点.

已知:

| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝.
②试管C置于冰水浴中的目的是进一步冷却,防止环己烯挥发.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上层(填“上”或“下”),分液后用c(填选项字母)洗涤.
a.KMnO4溶液 b.稀硫酸 c.Na2CO3溶液
②再将环己烯按如图2装置蒸馏,冷却水从g口进入.蒸馏时要加入生石灰,目的是除去了残留的水.
③收集产品时,控制的温度应在83℃左右,实验制得的环己烯精品质量低于理论产量,可能的原因是c(填选项字母).
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是bd(填选项字母).
a.用酸性高锰酸钾溶液 b.用金属钠 c.用溴水 d.测定沸点.
2.科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:NaHCO3+H2$?_{释氢}^{储氢}$HCOONa+H2O下列有关说法正确的是( )
| A. | 储氢、释氢过程均无能量变化 | |
| B. | 释氢过程中,每消耗0.1molH2O放出2.24L的H2 | |
| C. | 上述储氢原理和钢瓶储氢原理相同 | |
| D. | NaHCO3含有离子键和共价键 |
16.某塑料的中间体M的结构简式为 ,有关说法错误的是( )
,有关说法错误的是( )
 ,有关说法错误的是( )
,有关说法错误的是( )| A. | M的分子式为C12H16O6 | |
| B. | 含有的官能团为羟基、酯基和碳碳双键 | |
| C. | 能发生酯化、水解、加成、氧化等反应 | |
| D. | 1molM能与3molH2加成 |
14.某同学将燃着的红磷放入装有氧气的集气瓶中燃烧,一段时间后,红磷熄灭,他立刻将燃烧匙取出,但此时红磷又开始燃烧.解释这种现象的说法错误的是( )
| A. | 红磷又接触到氧气 | |
| B. | 红磷的温度还高于它的着火点 | |
| C. | 燃烧时红磷转变成白磷,降低了着火点 | |
| D. | 瓶内的氧气不能耗尽红磷 |
15.向纯水中加入少量的硫酸氢钠(溶液温度不变),则溶液的( )
| A. | pH值不变 | B. | pH值减小 | C. | 水的离子积增大 | D. | c(OH-)不变 |
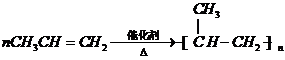 ,
, ,
, .
.