题目内容
3.氮元素可形成卤化物、叠氮化物及络合物等.(1)NF3构型为三角锥体,沸点-129℃;NF3属于分子晶体;
(2)氢叠氮酸(HN3)是一种弱酸,它的酸性类似于醋酸,微弱电离出H+和N3-.
①与N3-互为等电子体的分子、离子有:N2O或CO2或CS2或BeCl2、SCN-或OCN-或CNO-(各举1例),N3-的空间构型是直线型;②叠氮化物、氰化物能与Fe3+及Cu2+及Co3+等形成络合物,如:Co1(N3)(NH3)5]SO4、Fe(CN)64-.写出钴原子在基态时的价电子排布式:3d74s2,Co1(N3)(NH3)5]SO4中钴的配位数为6,CN-中C原子的杂化类型是sp;
(3)化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中一种异构体具有水的可溶性,则此种化合物是
极性(填“极性”、“非极性”)分子.
分析 (1)由沸点判断晶体类型,一般分子晶体的沸点较低;
(2)①原子个数相等且价电子数相等的微粒为等电子体;根据空间构型的判断方法判断;
②钴是37号元素,其基态原子核外电子排布式为[Ar]3d74s2;根据配位数的判断方法判断;CN-的结构式为[C≡N]-,根据C原子的价层电子对数判断;
(3)水为极性溶剂,根据相似相溶原理判断.
解答 解:(1)NF3的沸点较低,所以是分子晶体;
故答案为:分子;
(2)①N3-含有三个原子22个电子,与其等电子体的分子有N2O或CO2或CS2或BeCl2,与其等电子体的离子有 SCN-或OCN-或CNO;N3-与CO2是等电子体,具有相同的价电子数,它们具有相似的化学结构,二氧化碳是直线型分子,所以N3-的空间构型是直线型.
故答案为:N2O或CO2或CS2或BeCl2; SCN-或OCN-或CNO-;直线;
②钴是37号元素,其基态原子核外电子排布式为[Ar]3d74s2,所以其原子在基态时的价电子排布式为3d 74s2;
Co[(N3)(NH3)5]SO4的配位数是1+5=6;CN-的结构式为[C≡N]-,C原子的价层电子对数为2,所以采取sp杂化.
故答案为:3d 74s2;6;sp;
(3)极性分子易溶于极性溶剂中,已知水为极性溶剂,Pt(NH3)2Cl2的一种分子易溶于水,说明为极性分子;
故答案为:极性.
点评 本题考查物质结构与性质,涉及晶体类型的判断、核外电子排布式的书写、配位数的判断、等电子体、杂化类型的判断等知识点,这些都是高考热点,要注重基础知识的积累,题目难度中等.

练习册系列答案
相关题目
13.下列说法错误的是( )
| A. | 石油里含有C5~C11的烷烃,可以通过石油的分馏得到汽油 | |
| B. | 含有C18以上的烷烃的重油经过催化裂化可以得到汽油 | |
| C. | 石油的分馏是一个物理过程,而裂化及裂解属于化学过程 | |
| D. | 石油裂解的惟一目的是获得乙烯 |
14.过氧化钙(CaO2)作为食品添加剂,具有无毒安全、价格低廉、效果明显等优点.回答有关CaO2的说法错误的是( )
| A. | 具有氧化性 | B. | 具有还原性 | C. | 具有漂白性 | D. | 含有极性键 |
8. 向表的甲物质中逐滴加入乙溶液至过量,反应过程中生成气体或沉淀的质量与加入乙的质量关系,能用下图表示的是( )
向表的甲物质中逐滴加入乙溶液至过量,反应过程中生成气体或沉淀的质量与加入乙的质量关系,能用下图表示的是( )
 向表的甲物质中逐滴加入乙溶液至过量,反应过程中生成气体或沉淀的质量与加入乙的质量关系,能用下图表示的是( )
向表的甲物质中逐滴加入乙溶液至过量,反应过程中生成气体或沉淀的质量与加入乙的质量关系,能用下图表示的是( )| 序号 | 甲 | 乙 |
| A | 镁条 | 稀硫酸 |
| B | 硫酸铁溶液 | 氢氧化钠溶液 |
| C | 硝酸钡溶液 | 硫酸钠溶液 |
| D | 生锈的铁钉 | 稀硫酸 |
| A. | A | B. | B | C. | C | D. | D |
15.宋代著名法医学家宋慈 的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理是4Ag+2H2S+O2═2Ag2S+2H2O,其中H2S是( )
| A. | 氧化剂 | B. | 还原剂 | ||
| C. | 既是氧化剂又是还原剂 | D. | 既不是氧化剂又不是还原剂 |
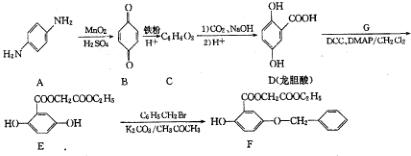
 ;
; ;
;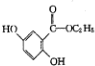 )的一种同分异构体的结构简式
)的一种同分异构体的结构简式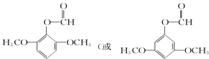 ;
;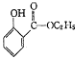 )的合成路线流程图(无机试剂任用),相关信息:
)的合成路线流程图(无机试剂任用),相关信息: .
.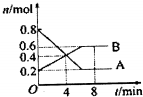 某温度时,在0.5L密闭容器中某一反应的A、B气体物质随时间变化的曲线如图所示,完成下列问题:
某温度时,在0.5L密闭容器中某一反应的A、B气体物质随时间变化的曲线如图所示,完成下列问题: ;已知甲为二元弱酸,写出甲在水中电离出一个H+的电离方程式H2O2?H++HO2-.
;已知甲为二元弱酸,写出甲在水中电离出一个H+的电离方程式H2O2?H++HO2-.