题目内容
18.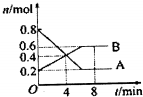 某温度时,在0.5L密闭容器中某一反应的A、B气体物质随时间变化的曲线如图所示,完成下列问题:
某温度时,在0.5L密闭容器中某一反应的A、B气体物质随时间变化的曲线如图所示,完成下列问题:(1)写出反应的化学方程式;
(2)计算平衡时A的转化率.
分析 (1)根据参加反应的物质的物质的量之比等于化学计量数之比书写化学方程式;
(2)根据平衡时A物质变化了的物质的量与A物质起始的物质的量之比,可求得A的转化率.
解答 解:(1)由图象可知,A的物质的量逐渐减小,应为反应物,B的物质的量逐渐增加,应为生成物,参加反应的物质的物质的量之比等于化学计量数之比,
则:n(A):n(B)=(0.8mol-0.2mol):(0.6mol-0.4mol)=3:2,所以反应的化学方程式为3A?2B,
答:反应的化学方程式3A?2B;
(2)图象分析可知A起始量0.8mol,达到平衡状态消耗A物质的量0.8mol-0.2mol=0.6mol,平衡时A的转化率为$\frac{0.8mol-0.2mol}{0.8mol}$×100%=75%,
答:平衡时A的转化率为75%.
点评 本题考查化学反应速率变化曲线及应用和转化率的计算,题目难度不大,注意分析图象曲线的变化趋势,把握化学平衡状态的特征.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.已知分子式为C4H8C12的有机物同分异构体共有9种,则C4H2C18的同分异构体数目为( )
| A. | 5种 | B. | 7种 | C. | 9种 | D. | 13种 |
10.CO和NO都是汽车尾气里的有害物质,它们能缓慢地起反应生成氮气和二氧化碳.对此反应下列叙述正确的是( )
| A. | 使用催化剂不改变反应速率 | B. | 降低压强能加快反应速率 | ||
| C. | 升高温度能加快反应速率 | D. | 改变压强对反应速率无影响 |

 中国科学院长春应用化学研究所在甲烷燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲烷燃料电池的工作原理如图所示.
中国科学院长春应用化学研究所在甲烷燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲烷燃料电池的工作原理如图所示. 某校研究性学习小组用已部分生锈(Fe2O3)的废铁屑,制作印刷电路板的腐蚀剂,即FeCl3溶液.实验操作过程如下:
某校研究性学习小组用已部分生锈(Fe2O3)的废铁屑,制作印刷电路板的腐蚀剂,即FeCl3溶液.实验操作过程如下: