题目内容
18.汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应:N2(g)+O2(g)?2NO(g)△H>0,已知该反应在240℃,平衡常数K=64×10-4.请回答:(1)某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5mol,则N2的反应速率为0.05mol/(L.min).
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志AD.
A.消耗1mol N2同时生成1mol O2 B.混合气体密度不变
C.混合气体平均相对分子质量不变D.2v正(N2)=v逆(NO)
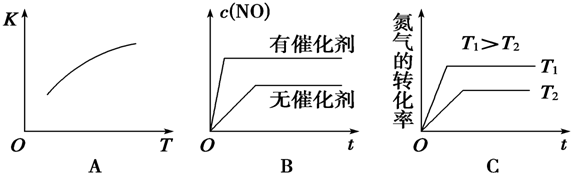
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下图变化趋势正确的是AC(填字母序号).
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态.与原平衡状态相比,此时平衡混合气中NO的体积分数不变.(填“变大”、“变小”或“不变”)
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol•L-1、4.0×10-2 mol•L-1和3.0×10-3 mol•L-1,此时反应向正反应方向进行(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是浓度商小于平衡常数.
分析 (1)参加反应的n(O2)=(1-0.5)mol=0.5mol,则参加反应的n(N2)=n(O2)(反应)=0.5mol,v(N2)=$\frac{\frac{△n}{V}}{△t}$;
(2)可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变;
(3)A.该反应的正反应是吸热反应,升高温度平衡正向移动;
B.催化剂加快反应速率,缩短反应到达平衡的时间,但平衡不移动;
C.温度越高,化学反应速率越快,反应到达平衡的时间越短,升高温度平衡正向移动,氮气的转化率增大;
(4)该反应前后气体物质的量不变,反应达到平衡后再加入NO,化学反应速率增大,加入NO相当于增大压强平衡不移动;
(5)先计算浓度商,根据化学平衡常数与浓度商相对大小确定反应方向.
解答 解:(1)参加反应的n(O2)=(1-0.5)mol=0.5mol,则参加反应的n(N2)=n(O2)(反应)=0.5mol,v(N2)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.5mol}{2L}}{5min}$=0.05mol/(L.min),
故答案为:0.05mol/(L.min);
(2)A.消耗1mol N2同时生成1mol O2,生成1mol O2同时生成1mol N2,氮气正逆反应速率相等,反应达到平衡状态,故A正确;
B.反应前后气体总质量不变、容器体积不变,所以无论反应是否达到平衡状态,混合气体密度始终不变,不能据此判断平衡状态,故B错误;
C.反应前后气体总物质的量不变、质量不变,则混合气体平均相对分子质量不变,不能据此判断平衡状态,故C错误;
D.2v正(N2)=v逆(NO)=2v逆(N2),正逆反应速率相等,反应达到平衡状态,故D正确;
故选AD;
(3)A.该反应的正反应是吸热反应,升高温度平衡正向移动,化学平衡常数增大,符合图象,故A正确;
B.催化剂加快反应速率,缩短反应到达平衡的时间,但平衡不移动,所以NO浓度相同,不符合图象,故B错误;
C.温度越高,化学反应速率越快,反应到达平衡的时间越短,升高温度平衡正向移动,氮气的转化率增大,符合图象,故C正确;
故选AC;
(4)该反应前后气体物质的量不变,反应达到平衡后再加入NO,化学反应速率增大,加入NO等效为增大压强平衡不移动,各物质的含量不变,所以此时平衡混合气中NO的体积分数不变,
故答案为:不变;
(5)浓度商=$\frac{(3×1{0}^{-3})^{2}}{2.5×1{0}^{-1}×4.0×1{0}^{-2}}$=9×10-4<K,平衡正向移动,
故答案为:向正反应方向进行;浓度商小于平衡常数.
点评 本题考查化学平衡计算、化学平衡状态判断、外界条件对化学平衡移动影响等知识点,侧重考查学生分析判断及计算能力,明确化学反应原理及平衡状态判断依据是解本题关键,难点是(4)题判断,注意等效平衡的灵活运用,题目难度中等.

①200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g.若向该沉淀中加入过量的盐酸,仍有2.33g沉淀不溶.
②向①的滤液中加入足量的KOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体0.672L(已换算成标准状况,假定产生的气体全部逸出).
③将②溶液进行焰色反应实验,透过蓝色的钴玻璃看到了紫色火焰.
| A. | 一定存在K+、SO42-、CO32-、NH4+,可能存在Na+、Cl- | |
| B. | 一定存在K+、SO42-、CO32-、NH4+,一定不存在Cl-、Na+ | |
| C. | 一定存在SO42-、CO32-、NH4+,可能存在K+、Na+,一定不存在Cl- | |
| D. | 一定存在SO42-、CO32-、NH4+,可能存在K+、Na+、Cl- |
 A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:
A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:| … | E | A | B | ||
| C | … | D |
(2)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中可能引起的环境问题有:酸雨(或光化学烟雾)(任写一种).
(3)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是Na3N+4H2O=NH3.H2O+3NaOH.
(4)将 A氢化物的气体和D的氢化物气体混合现象是产生白烟,化学反应方程式为NH3+HCl=NH4Cl.
(5)写出F的单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
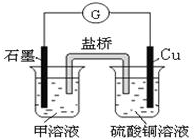
(6)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图所示,其反应中正极反应式为2Fe3++2e-=2Fe2+,负极反应为Cu-2e-=Cu2+.
| A. | 30min时降低温度,40min时升高温度 | |
| B. | 8min前A的平均反应速率为0.17mol/(L•min) | |
| C. | 反应方程式中的x=1,正反应为放热反应 | |
| D. | 20min~40min间该反应的平衡常数均为4 |
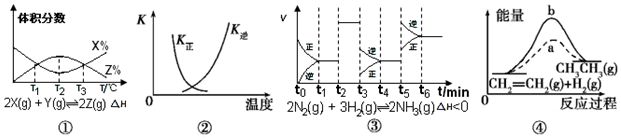
| A. | 由图①知,反应在T1、T3处达到平衡,且该反应的△H<0 | |
| B. | 图②中曲线表示反应2SO2(g)+O2(g)?2SO3(g),△H<0正、逆反应的平衡常数K随温度的变化 | |
| C. | 由图③知,反应在t6时,NH3体积分数最大,t3时采取降低反应温度的措施 | |
| D. | 图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化 |