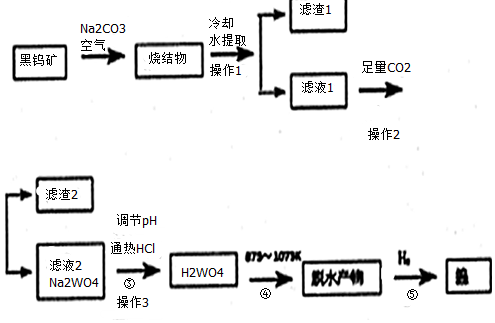
题目内容
1.X、Y、Z、W为4种短周期元素.已知:①X、W同主族,Y、Z同主族;②X、Y可形成两种液态化合物X2Y和X2Y2;③X2Z和ZY2之间可发生反应生成Z单质;④W2Y2和X2Y之间可发生反应生成Y单质.请完成下列问题:
(1)X、Y元素的名称为X氢,Y氧.
(2)写出W2Y2的电子式:
 ,Z的原子结构示意图为
,Z的原子结构示意图为 .
.(3)写出④中反应的化学方程式2Na2O2+2H2O═4NaOH+O2↑.
分析 X、Y、Z、W是原子序数依次增大的短周期元素,X、Y可形成两种化合物X2Y和X2Y2,应是H、O或者Na、O形成的化合物,结合原子原子序数可知,X为H元素、Y为O元素,形成的化合物分别为H2O和H2O2,X、W同主族,可知W为Na元素,Y、Z同主族,则Z为S元素,H2S和SO2之间可发生反应生成S单质,Na2O2和H2O之间可发生反应生成氧气,以此解答该题.
解答 解:(1)X为氢元素,Y为氧元素,故答案为:氢;氧;
(2)W2Y2为过氧化钠,为离子化合物,电子式为 ,Z为S元素,原子核外有3个电子层,最外层电子数为6,原子结构示意图为
,Z为S元素,原子核外有3个电子层,最外层电子数为6,原子结构示意图为 ,
,
故答案为: ;
; ;
;
(3)过氧化钠和水反应生成氢氧化钠和氧气,反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na2O2+2H2O═4NaOH+O2↑.
点评 本题考查元素化合物推断,为高频考点,侧重于学生的分析能力的考查,属于猜测验证型推断,熟练掌握中学常见物质组成以及元素化合物性质,难度中等.

练习册系列答案
相关题目
13.少量铁粉与100mL 0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①滴入几滴浓盐酸
②加NaCl溶液
③滴入几滴硫酸铜溶液
④升高温度(不考虑盐酸挥发)
⑤改用 19.6mol/L的硫酸溶液.
①滴入几滴浓盐酸
②加NaCl溶液
③滴入几滴硫酸铜溶液
④升高温度(不考虑盐酸挥发)
⑤改用 19.6mol/L的硫酸溶液.
| A. | ①③④ | B. | ②④ | C. | ①④ | D. | ①④⑤ |
9.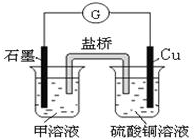 A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:
A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:
(1)A元素在周期表中的位置是第二周期第ⅤA族.
(2)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中可能引起的环境问题有:酸雨(或光化学烟雾)(任写一种).
(3)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是Na3N+4H2O=NH3.H2O+3NaOH.
(4)将 A氢化物的气体和D的氢化物气体混合现象是产生白烟,化学反应方程式为NH3+HCl=NH4Cl.
(5)写出F的单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(6)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图所示,其反应中正极反应式为2Fe3++2e-=2Fe2+,负极反应为Cu-2e-=Cu2+.
 A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:
A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:| … | E | A | B | ||
| C | … | D |
(2)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中可能引起的环境问题有:酸雨(或光化学烟雾)(任写一种).
(3)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是Na3N+4H2O=NH3.H2O+3NaOH.
(4)将 A氢化物的气体和D的氢化物气体混合现象是产生白烟,化学反应方程式为NH3+HCl=NH4Cl.
(5)写出F的单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(6)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图所示,其反应中正极反应式为2Fe3++2e-=2Fe2+,负极反应为Cu-2e-=Cu2+.
11.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 含有NA个NO2、N2O4分子的混合气体降低温度,混合气体的分子数目小于NA | |
| B. | 常温常压和光照条件下,33.6 LCl2与3.0g H2反应,生成的HCl分子数目为3NA | |
| C. | 1.68 g Fe和足量水蒸气反应,转移的电子数目为0.09NA | |
| D. | 一定条件下,1 mol N2和3 mol H2充分反应,生成物中含N-H键数目为6NA |