题目内容
20.按要求完成下列各题(1)写出碳酸氢钠在水溶液中的电离方程式NaHCO3═Na++HCO3-
(2)写出下列反应的离子方程式:
①氧化镁加入稀硫酸中MgO+2H+=Mg2++H2O
②氨水中加入稀盐酸NH3•H2O+H+=NH4++H2O
③把二氧化碳通入足量的澄清石灰水中Ca2++2OH-+CO2=CaCO3↓+H2O
④向Ba(OH)2溶液中逐滴滴入NaHSO4溶液至Ba2+ 恰好沉淀完全H++SO42-+Ba2++OH-=BaSO4↓+H2O.
分析 (1)碳酸氢钠为强电解质,在溶液中完全电离出钠离子和碳酸氢根离子;
(2)①氧化镁与稀硫酸反应生成硫酸镁和水;
②氨水为弱碱,离子方程式中一水合氨需要保留分子式;
③澄清石灰水足量,二者反应生成碳酸钙沉淀和水;
④钡离子恰好沉淀完全时,二者物质的量之比为1:1.
解答 解:(1)碳酸氢钠在水中电离出钠离子和碳酸氢根离子,电离方程式为:NaHCO3═Na++HCO3-,
故答案为:NaHCO3═Na++HCO3-;
(2)①氧化镁加入稀硫酸中,二者反应生成硫酸镁和水,反应的离子方程式为:MgO+2H+=Mg2++H2O,
故答案为:MgO+2H+=Mg2++H2O;
②氨水中加入稀盐酸,二者反应生成氯化铵,反应的离子方程式为:NH3•H2O+H+=NH4++H2O,
故答案为:NH3•H2O+H+=NH4++H2O;
③把二氧化碳通入足量的澄清石灰水中,反应生成碳酸钙和水,离子反应为:Ca2++2OH-+CO2=CaCO3↓+H2O,
故答案为:Ca2++2OH-+CO2=CaCO3↓+H2O;
④向Ba(OH)2溶液中逐滴滴入NaHSO4溶液至Ba2+ 恰好沉淀完全,此时氢氧化钡与硫酸氢钠按照物质的量1:1反应,反应的离子方程式为:H++SO42-+Ba2++OH-=BaSO4↓+H2O,
故答案为:H++SO42-+Ba2++OH-=BaSO4↓+H2O.
点评 本题考查了离子方程式、电离方程式的书写,题目难度中等,明确电离方程式、离子方程式的书写原则为解答关键,试题知识点较多,充分考查学生的分析能力及灵活应用基础知识的能力.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
11.一定条件下2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1;CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ•mol-1,则1molCO和3molCH4组成的混合气体在上述条件下完全燃烧放出的热量为( )
| A. | 2912 kJ | B. | 2953 kJ | C. | 3236 kJ | D. | 3836 kJ |
8.在同温同压下,A容器中的氧气(O2)和B容器中的氨气(NH3)所含的原子个数相同,则A、B两容器中气体的体积之比是( )
| A. | 1:2 | B. | 2:1 | C. | 1:1 | D. | 无法比较 |
15.下列同一组反应的反应类型不相同的是( )
| A. | 1-丁烯使溴水褪色,乙炔制取氯乙烯 | |
| B. | 苯乙烯制取聚苯乙烯,四氟乙烯制取聚四氟乙烯 | |
| C. | 1-己烯使KMnO4酸性溶液褪色,甲苯使KMnO4酸性溶液褪色 | |
| D. | 由氯代环己烷制环己烯;由丙烯制1,2-二溴丙烷 |
5.下列有机物检验方法正确的是( )
| A. | 取少量卤代烃加NaOH水溶液共热,冷却,再加AgNO3溶液检验卤原子存在 | |
| B. | 苯和乙烯都能使溴水褪色,但褪色的原理是不同的 | |
| C. | 用溴水可以鉴别乙烯与乙炔 | |
| D. | 苯和苯的同系物都可以用酸性高锰酸钾溶液鉴别 |
9.某无色溶液中可能含有下列离子中的某几种:K+、Cl-、SO42-、CO32-、NH4+、Na+.为确认溶液组成进行如下实验( )
①200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g.若向该沉淀中加入过量的盐酸,仍有2.33g沉淀不溶.
②向①的滤液中加入足量的KOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体0.672L(已换算成标准状况,假定产生的气体全部逸出).
③将②溶液进行焰色反应实验,透过蓝色的钴玻璃看到了紫色火焰.
①200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g.若向该沉淀中加入过量的盐酸,仍有2.33g沉淀不溶.
②向①的滤液中加入足量的KOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体0.672L(已换算成标准状况,假定产生的气体全部逸出).
③将②溶液进行焰色反应实验,透过蓝色的钴玻璃看到了紫色火焰.
| A. | 一定存在K+、SO42-、CO32-、NH4+,可能存在Na+、Cl- | |
| B. | 一定存在K+、SO42-、CO32-、NH4+,一定不存在Cl-、Na+ | |
| C. | 一定存在SO42-、CO32-、NH4+,可能存在K+、Na+,一定不存在Cl- | |
| D. | 一定存在SO42-、CO32-、NH4+,可能存在K+、Na+、Cl- |
9.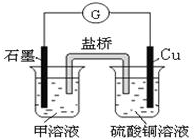 A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:
A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:
(1)A元素在周期表中的位置是第二周期第ⅤA族.
(2)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中可能引起的环境问题有:酸雨(或光化学烟雾)(任写一种).
(3)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是Na3N+4H2O=NH3.H2O+3NaOH.
(4)将 A氢化物的气体和D的氢化物气体混合现象是产生白烟,化学反应方程式为NH3+HCl=NH4Cl.
(5)写出F的单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(6)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图所示,其反应中正极反应式为2Fe3++2e-=2Fe2+,负极反应为Cu-2e-=Cu2+.
 A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:
A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:| … | E | A | B | ||
| C | … | D |
(2)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中可能引起的环境问题有:酸雨(或光化学烟雾)(任写一种).
(3)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是Na3N+4H2O=NH3.H2O+3NaOH.
(4)将 A氢化物的气体和D的氢化物气体混合现象是产生白烟,化学反应方程式为NH3+HCl=NH4Cl.
(5)写出F的单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(6)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图所示,其反应中正极反应式为2Fe3++2e-=2Fe2+,负极反应为Cu-2e-=Cu2+.
