题目内容
18.T℃时,在容积为2L的3个恒容密闭容器中发生反应:3A(g)+B(g)?xC(g),按不同方式投入反应物,测得反应达到平衡时的有关数据如下:| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3mol A、2mol B | 6mol A、4mol B | 2mol C |
| 到达平衡的时间(min) | 5 | 8 | |
| A的浓度(mol/L) | c1 | c2 | |
| C的体积分数 | w1 | w3 | |
| 混合气体密度(g/L) | ρ1 | ρ2 |
| A. | 若x<4,则2c1>c2 | |
| B. | 若x=4,则w3=w1 | |
| C. | 无论x的值是多少,均有2ρ1=ρ2 | |
| D. | 容器甲达到平衡所需的时间比容器乙达到平衡所需的时间短 |
分析 A.恒温恒容下,乙等效为在甲中平衡基础上压强增大一倍,若x<4,则正反应为气体体积减小的反应,平衡正向移动,则乙中反应物转化率高于A中反应物转化率;
B.若x=4,反应前后气体的体积不变,开始只投入C与起始投料比n(A):n(B)=3:1为等效平衡,平衡时同种物质的含量相等,甲中起始投料比为3:2,等效为在起始投料比n(A):n(B)=3:1的基础上再加入1份的B,平衡正向移动,平衡正向移动,B的转化率降低,B的含量增大,A的含量减低,C的含量不能确定;
C.起始乙中同种物质的投入量是甲的2倍,根据质量守恒定律知,乙中气体质量为甲中2倍,容器的容积相等;
D.起始浓度越大,反应速率越快,到达平衡时间越短.
解答 解:A.恒温恒容下,乙等效为在甲中平衡基础上压强增大一倍,若x<4,则正反应为气体体积减小的反应,平衡正向移动,则乙中反应物转化率高于A中反应物转化率,则2c1>c2,故A正确;
B.若x=4,反应前后气体的体积不变,开始只投入C与起始投料比n(A):n(B)=3:1为等效平衡,平衡时同种物质的含量相等,甲中起始投料比为3:2,等效为在起始投料比n(A):n(B)=3:1的基础上再加入1份的B,平衡正向移动,B的转化率降低,B的含量增大,A的含量减低,C的含量不能确定,故B错误;
C.起始乙中同种物质的投入量是甲的2倍,根据质量守恒定律知,乙中气体质量为甲中2倍,容器的容积相等,则一定存在2ρ1=ρ2,故C正确;
D.乙中起始浓度越大,反应速率越快,到达平衡时间更短,故D错误,
故选AC.
点评 本题考查等效平衡,浓度中等,注意理解等效平衡规律:1、恒温恒容,反应前后气体体积不等,按化学计量数转化到一边,对应物质满足等量;反应前后气体体积相等,按化学计量数转化到一边,对应物质满足等比,2:恒温恒压,按化学计量数转化到一边,对应物质满足等比.

| A. | FeCl3 | B. | Na2CO3 | C. | K2SO3 | D. | TiCl4 |

| A. | 双氢青蒿素属于酯类物质 | |
| B. | 青蒿素的分子式为C15H22O5 | |
| C. | 青蒿素环上的一氢取代物有11种 | |
| D. | 青蒿素通过加成反应可以转化为双氢青蒿素 |
| A. | 乙烯能使酸性高锰酸钾溶液褪色,甲烷则不能使其褪色 | |
| B. | 溶于水能导电的化合物不一定是离子化合物 | |
| C. | 需要加热的反应不一定是吸热反应 | |
| D. | 石油的分馏和煤的干馏都是化学变化 |
| A. | 150mL 1 mol/L氯化钠溶液 | B. | 75mL 2 mol/L氯化镁溶液 | ||
| C. | 50mL 3 mol/L氯化钾溶液 | D. | 50mL 1 mol/L氯化铁溶液 |
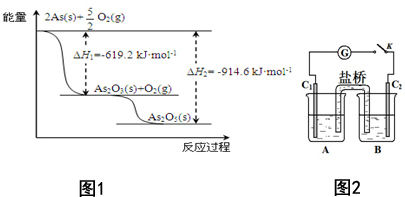 对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一.
对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一.