题目内容
8.将190g MgCl2溶于水配制成1L溶液.(1)该溶液中MgCl2的物质的量浓度为2mol/L,溶液中Cl-的物质的量浓度为4mol/L.
(2)配制1mol•L-1的MgCl2溶液500mL,需该溶液的体积为0.25L.
(3)向(2)中500mL溶液中再通入一定量的HCl气体后,溶液中Cl-的物质的量浓度为3mol•L-1(假设溶液体积不变),则溶液中H+的物质的量浓度为1mol/L,通入HCl气体的体积(标准状况下)为11.2L.
分析 (1)根据MgCl2的质量求出MgCl2的物质的量,然后根据c=$\frac{n}{V}$求出物质的量浓度;根据MgCl2的物质的量浓度以及1个MgCl2中含有2个氯离子求出Cl-的物质的量浓度;
(2)根据溶液稀释前后溶质的物质的量不变;
(3)根据(2)可知Cl-的物质的量浓度2 mol/L,通入一定量的HCl气体后,溶液中Cl-的物质的量浓度为3mol/L,所以由HCl气体溶与水后产生的Cl-的物质的量浓度为1mol/L,然后求出HCl的物质的量、体积以及H+的物质的量浓度.
解答 解:(1)MgCl2的物质的量为n(MgCl2)$\frac{190g}{95g/mol}$=2mol,则MgCl2物质的量浓度为c=$\frac{n}{V}$=$\frac{2mol}{1L}$=2 mol/L,溶液中Cl-的物质的量浓度C(Cl-)=2C(MgCl2)=4mol/L,故答案为:2mol/L;4mol/L;
(2)因溶液稀释前后溶质的物质的量不变,所以需该溶液的体积为V=$\frac{1mol/L×0.5L}{2mol/L}$=0.25L,故答案为:0.25L;
(3)因(2)中Cl-的物质的量浓度2 mol/L,通入一定量的HCl气体后,溶液中Cl-的物质的量浓度为3mol/L,所以由HCl气体溶与水后产生的Cl-的物质的量浓度为1mol/L,H+的物质的量浓度也为1mol/L,HCl的物质的量为:1mol/L×0.5L=0.5mol,体积为0.5mol×22.4L/mol=11.2L,故答案为:1mol/L;11.2L.
点评 本题考查物质的有关计算,题目难度不大,本题注意把握物质的量与质量、浓度等物理量的计算公式的运用.

练习册系列答案
相关题目
19.检验某溶液含有氯离子的试剂合理的是( )
| A. | AgNO3溶液 | B. | KI淀粉试纸 | ||
| C. | 稀HNO3和AgNO3溶液 | D. | NaBr溶液和CCl4 |
13.化学与生活、生产密切相关,下列有关说法正确的是( )
| A. | 硅晶体具有半导体性能,可用于制取光导纤维 | |
| B. | 二氧化硫可以漂白纸浆 | |
| C. | 硅酸可以用于刻蚀玻璃 | |
| D. | 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 |
20.某太阳能电池的工作原理如图所示.下列说法正确的是( )
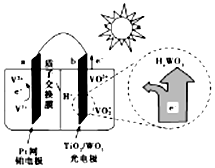

| A. | 光照时,b极的电极反应式为VO2+-e-+H2O═VO2++2H+ | |
| B. | 光照时,毎转移2mol电子,有2mol H+由a极区经质子交换膜向b极区迁移 | |
| C. | 夜间,a极的电极反应式为V3++e-═V2+ | |
| D. | 硅太阳能电池供电原理与该电池相同 |
17.下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是( )
①向饱和碳酸钠溶液中通入CO2至过量
②向Fe(OH)3胶体中逐滴加入稀盐酸至过量
③向NaAlO2 溶液中通入CO2至过量
④向 AlCl3溶液中加入 Ba(OH)2溶液至过量
⑤向CaCl2溶液中通入 CO2 至过量.
①向饱和碳酸钠溶液中通入CO2至过量
②向Fe(OH)3胶体中逐滴加入稀盐酸至过量
③向NaAlO2 溶液中通入CO2至过量
④向 AlCl3溶液中加入 Ba(OH)2溶液至过量
⑤向CaCl2溶液中通入 CO2 至过量.
| A. | ①③⑤ | B. | ①② | C. | ①③ | D. | ②③⑤ |
18.下列物质的水溶液因水解而呈碱性的是( )
| A. | NaOH | B. | NH4Cl | C. | NaCl | D. | Na2CO3 |
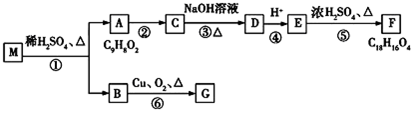
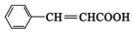 ,E中含有官能团的名称是羟基、羧基.
,E中含有官能团的名称是羟基、羧基. 或
或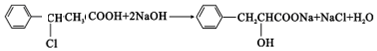 、2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O.
、2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O.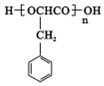 或
或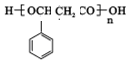 ,由E导H的反应类型为缩聚反应.
,由E导H的反应类型为缩聚反应.