题目内容
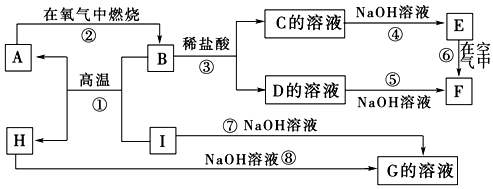
13.四氯化钛(TiCl4)是制取航天工业材料--钛合金的重要原料.实验室以TiO2和CCl4为原料制取液态TiCl4的装置如图所示(部分夹持装置省略).
已知:有关物质的性质如表:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾,在550℃时能被氧气氧化 |
(1)仪器A的名称是球形干燥管,仪器A中盛装的试剂是碱石灰或生石灰、氢氧化钠,氯化钙等.
(2)CCl4的电子式为
 .
.(3)装置C处硬质玻管中反应的化学方程式为TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g).
(4)TiCl4遇潮湿空气会产生TiO2,反应的化学方程式为TiCl4+2H2O=TiO2+4HCl.
(5)仪器N中收集到的物质主要有CCl4、TiCl4(写化学式),从产物中分离出TiCl4的实验方法是蒸馏.
(6)TiCl4还可由TiO2、焦炭和氯气在加热条件下制得,生成体积比为2:1的CO和CO2混合气体,该感应中氧化剂与还原剂的物质的量之比为4:3.请设计实验方案验证产物气体中有CO:将产物气体依序通入足量的NaOH溶液→干燥剂→灼热的CuO→澄清石灰水,若最终澄清石灰水变浑浊,灼热的CuO固体由黑色变红色,则产物中有CO.
分析 以TiO2和CCl4为原料制取液态TiCl4的装置:通过氮气将装置中空气排出,防止TiCl4被氧化,A为干燥管,干燥氮气,防止生成的TiCl4遇潮湿的气体产生白雾;B装置加热使四氯化碳挥发,C中装置在加热条件下,发生反应TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),CCl4、TiCl4熔点较低,D装置使这两种物质转化为液态,二者能互溶,应该采用蒸馏方法分离,E装置连接空气,应该盛放浓硫酸,干燥空气,据此分析解答.
解答 解:(1)由仪器构造可知仪器A为球形干燥管,盛放碱石灰或生石灰、氢氧化钠,氯化钙等,故答案为:球形干燥管;碱石灰或生石灰、氢氧化钠,氯化钙等;
(2)四氯化碳分子碳原子分别与四个氯原子形成共用电子对,电子式为

(3)C中装置在加热条件下,发生反应TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g);
故答案为:TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g);
(4)由题可知四氯化碳遇潮湿空气产生白雾,说明有氯化氢生成,则反应方程式为:TiCl4+2H2O=TiO2+4HCl;
故答案为:TiCl4+2H2O=TiO2+4HCl;
(5)CCl4、TiCl4熔点较低,D装置使这两种物质转化为液态,二者能互溶,应该采用蒸馏方法分离;
故答案为:CCl4、TiCl4;蒸馏;
(6)TiCl4还可由TiO2、焦炭和氯气在加热条件下制得,生成体积比为2:1的CO和CO2混合气体,反应为:2TiO2+3C+4Cl2=2CO+CO2+2TiCl4,氯气化合价降低得电子作氧化剂,C化合价升高失电子作还原剂,则氧化剂与还原剂的物质的量之比为4:3;
验证产物气体中有CO,可利用CO的还原性,验证前排除其他气体,方法为:将产物气体依序通入足量的NaOH溶液→干燥剂→灼热的CuO→澄清石灰水,若最终澄清石灰水变浑浊,灼热的CuO固体由黑色变红色,则产物中有CO;
故答案为:4:3;将产物气体依序通入足量的NaOH溶液→干燥剂→灼热的CuO→澄清石灰水,若最终澄清石灰水变浑浊,灼热的CuO固体由黑色变红色,则产物中有CO.
点评 本题考查了物质制备方案设计,主要考查了化学方程式的书写、实验方案评价、氧化还原反应、环境保护等,题目难度中等,侧重于考查学生的分析问题和解决问题的能量,注意相关基础知识的学习与积累.

| A. | NaOH | B. | NH4Cl | C. | NaCl | D. | Na2CO3 |
| A. | Zn与稀H2SO4反应:2Zn+2H+═2Zn2++H2↑ | |
| B. | 氯气和水反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+═H2SiO3↓+2Na+ | |
| D. | 硫酸氢钠溶液与过量氢氧化钡溶液混合:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
| A. | 8g | B. | 9g | C. | 12g | D. | 13.5g |
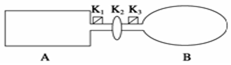 A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同.(已知:2NO2(g)?N2O4(g)△H<0)
A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同.(已知:2NO2(g)?N2O4(g)△H<0)