题目内容
硝酸工业的尾气中主要含有NO、NO2气体.下列关于它们的危害的叙述中,不正确的是( )
| A、NO、NO2是形成酸雨主要原因之一 |
| B、NO能在空气中稳定存在 |
| C、NO能跟血红蛋白作用引起中毒 |
| D、NO也能破坏臭氧层 |
考点:氮的氧化物的性质及其对环境的影响
专题:
分析:A.酸雨的pH小于5.6,一氧化氮在空气中可氧化为二氧化氮,NO和NO2等氮氧化物,为常见的空气污染物,能形成硝酸型酸雨;
B.一氧化氮和空气中氧气反应生成二氧化氮;
C.一氧化氮容易与血液中的血红蛋白结合,使人中毒;
D.一氧化氮(NO)可破坏臭氧层.
B.一氧化氮和空气中氧气反应生成二氧化氮;
C.一氧化氮容易与血液中的血红蛋白结合,使人中毒;
D.一氧化氮(NO)可破坏臭氧层.
解答:
解:A.正常雨水的pH约为5.6,酸雨的pH<5.6,硝酸工业的尾气中主要含有NO、NO2气体等物质是形成硝酸型酸雨的主要物质,故A正确;
B.一氧化氮和空气中氧气反应生成二氧化氮2NO+O2=2NO2,NO在空气中不能稳定存在,会继续反应,故B错误;
C.NO有毒,它能与血液中的血红蛋白结合,从而导致体内组织器官严重缺氧而死亡,故C正确;
D.氮氧化物NO和O3及O发生如下反应:O3+NO=NO2+O2 O+NO2=NO+O2,一氧化氮(NO)可破坏臭氧层,故D正确;
故选B.
B.一氧化氮和空气中氧气反应生成二氧化氮2NO+O2=2NO2,NO在空气中不能稳定存在,会继续反应,故B错误;
C.NO有毒,它能与血液中的血红蛋白结合,从而导致体内组织器官严重缺氧而死亡,故C正确;
D.氮氧化物NO和O3及O发生如下反应:O3+NO=NO2+O2 O+NO2=NO+O2,一氧化氮(NO)可破坏臭氧层,故D正确;
故选B.
点评:本题考查了氮的氧化物气体性质分析判断,题目难度不大,平时学习中注意积累、把握好常见气体物质的性质和用途即可正确解答本题.

练习册系列答案
 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共2.88g,经如下处理:下列说法正确的是( )

| A、滤液A中的阳离子为Fe2+、Fe3+、H+ |
| B、V=224 |
| C、样品中CuO的质量为2.0g |
| D、样品中Fe元素的质量为1.12 g |
已知反应X+Y=M+N为放热反应,对该反应的下列说法中正确的( )
| A、X的能量一定高于M |
| B、因该反应为放热反应,故不必加热就可发生 |
| C、Y的能量一定高于N |
| D、X和Y的总能量一定高于M和N的总能量 |
下列叙述中,正确的是( )
| A、铁制品上电镀锌时,理论上电镀液ZnCl2需要不断更换 |
| B、钢铁设备与外加直流电源的正极相连可以防止钢铁腐蚀 |
| C、甲烷燃料(KOH)电池的正极反应为:O2+2H2O+4e-=4OH- |
| D、粗铜精炼过程中,电路中每通过2mol电子,阳极就会溶解64g铜 |
下列说法中正确的是( )
| A、将58.5 g NaCl溶于1 L水中,所得溶液的物质的量浓度为1 mol/L |
| B、从1 L 2 mol/L的H2SO4溶液中取出0.5 L,所得溶液的浓度为1 mol/L |
| C、配制500 mL 0.5 mol/L的CuSO4溶液,需62.5 g胆矾 |
| D、中和100 g 19.6%的H2SO4溶液,需要NaOH 4 g |
下列表示对应化学反应的离子方程式正确的是( )
| A、铜与硝酸银溶液反应:Cu+Ag+=Cu2++Ag |
| B、氯气溶于水:Cl2+H2O?H++Cl-+HClO |
| C、硫酸溶液中滴加氢氧化钡溶液:H++SO42-+Ba2++OH-=H2O+BaSO4↓ |
| D、氯化钙溶液中通入二氧化碳气体:Ca2++CO2+H2O=CaCO3↓+2H+ |
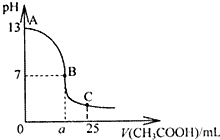 (1)用已知浓度的NaOH溶液测定某H2SO4溶液的浓度.选择
(1)用已知浓度的NaOH溶液测定某H2SO4溶液的浓度.选择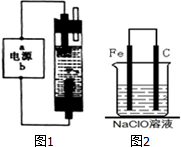 电化学与生产生活密切相关.请运用相关知识回答下列问题:
电化学与生产生活密切相关.请运用相关知识回答下列问题: