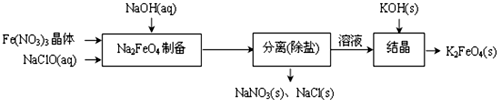
题目内容
 (1)用已知浓度的NaOH溶液测定某H2SO4溶液的浓度.选择
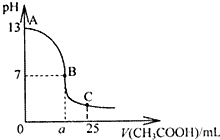
(1)用已知浓度的NaOH溶液测定某H2SO4溶液的浓度.选择(2)25℃时,在25mLNaOH溶液中,逐滴加入0.2mol?L-1CH3COOH溶液,溶液pH的变化曲线如图所示.(友情提醒:醋酸钠溶液呈碱性)
①原溶液中:c(NaOH)=
②在B点处:c(CH3COO-)
③a
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:(1)依据酸碱中和滴定实验基本操作分析回答,滴定的两个关键是准确量取溶液体积,准确判断反应终点,甲基橙变色范围3.1-4.4;
(2)①分析图象可知氢氧化钠溶液PH为=13,则氢氧化钠溶液浓度为0.1mol/L;
②B点溶液呈中性,结合溶液存在的电荷守恒分析判断;
③若醋酸体积为12.5ml,计算可知氢氧化钠和醋酸恰好反应溶液成碱性,a点是反应后溶液呈酸性,醋酸溶液体积大于12.5ml.
(2)①分析图象可知氢氧化钠溶液PH为=13,则氢氧化钠溶液浓度为0.1mol/L;
②B点溶液呈中性,结合溶液存在的电荷守恒分析判断;
③若醋酸体积为12.5ml,计算可知氢氧化钠和醋酸恰好反应溶液成碱性,a点是反应后溶液呈酸性,醋酸溶液体积大于12.5ml.
解答:
解:(1)滴定的两个关键是准确量取溶液体积,准确判断反应终点,准确量取溶液体积选择较准确的量具滴定管,将标准液NaOH放在锥形瓶中,用甲基橙作指示剂,滴定终点的判断为溶液由黄色变为橙色,且半分钟内不变色;
故答案为:碱式滴定管;溶液由黄色变为橙色,且半分钟内不变色;
(2)①图象可知氢氧化钠溶液PH为=13,则氢氧化钠溶液浓度为0.1mol/L,故答案为:0.1mol/L;
②在B点处氢氧化钠和醋酸反应后的溶液呈中性,c(H+)=c(OH-),溶液中存在电荷守恒,c(H+)+c(Na+)=c(OH-)+c(CH3COO-),则c(Na+)=c(CH3COO-),
故答案为:=;
③若醋酸体积为12.5ml,计算可知氢氧化钠和醋酸恰好反应溶液成碱性,a点是反应后溶液呈酸性,醋酸溶液体积大于12.5ml,故答案为:>.
故答案为:碱式滴定管;溶液由黄色变为橙色,且半分钟内不变色;
(2)①图象可知氢氧化钠溶液PH为=13,则氢氧化钠溶液浓度为0.1mol/L,故答案为:0.1mol/L;
②在B点处氢氧化钠和醋酸反应后的溶液呈中性,c(H+)=c(OH-),溶液中存在电荷守恒,c(H+)+c(Na+)=c(OH-)+c(CH3COO-),则c(Na+)=c(CH3COO-),
故答案为:=;
③若醋酸体积为12.5ml,计算可知氢氧化钠和醋酸恰好反应溶液成碱性,a点是反应后溶液呈酸性,醋酸溶液体积大于12.5ml,故答案为:>.
点评:本题考查了酸碱滴定实验的基本操作和实验过程分析判断、计算应用,掌握基础是关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
T℃时在2L容积不变的密闭容器中使X(g)与Y(g)发生反应生成Z(g).反应过程中X、Y、Z的浓度变化如图1所示.则下列结论正确的是( )
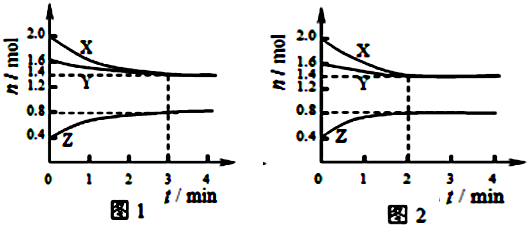

| A、容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g) |
| B、反应进行前3min内,用X表示的反应速率v(X)=0.1mol/(L?min) |
| C、若改变反应条件,使反应进程如图2所示,则改变的条件是增大压强 |
| D、如图1所示,该反应达到化学平衡时,X的转化率为70% |
下列各组物质不属于同分异构体的是( )
| A、苯和环己烷 |
| B、邻氯甲苯和对氯甲苯 |
| C、丙醛(CH3CH2CHO)和丙烯醇(CH2=CHCH2OH) |
| D、苯甲醇和对甲基苯酚 |
下列说法错误的是( )
| A、所有金属元素都可以用焰色反应来确定其存在 |
| B、三位美国科学家因给复杂化学体系设计多尺度模型面共享了2013年诺贝尔化学奖 |
| C、已知PM2.5是指大气中直径≤2.5微米的颗粒物,对人体健康危害很大 |
| D、借助仪器来分析化学物质的组成是常用的手段,原子吸收光谱常用来确定物质中含有哪些金属元素 |
下列有关物质用途的说法错误的是( )
| A、过氧化钠可用作潜水艇供氧剂 |
| B、氧化铝是一种耐火材料,可制耐高温实验材料 |
| C、氧化铁可用作红色油漆和涂料 |
| D、氢氧化铝、苏打等可用于治疗胃酸过多 |
硝酸工业的尾气中主要含有NO、NO2气体.下列关于它们的危害的叙述中,不正确的是( )
| A、NO、NO2是形成酸雨主要原因之一 |
| B、NO能在空气中稳定存在 |
| C、NO能跟血红蛋白作用引起中毒 |
| D、NO也能破坏臭氧层 |
关于如图所示装置的下列叙述,正确的是( )
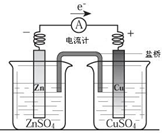

| A、电流方向是从锌片经导线流向铜片 |
| B、锌是阳极,锌片上有大量气泡产生 |
| C、铜离子在铜片表面被氧化,质量逐渐增大 |
| D、盐桥作用主要是离子通道和保持溶液电中性 |