题目内容
下列叙述中,正确的是( )
| A、铁制品上电镀锌时,理论上电镀液ZnCl2需要不断更换 |
| B、钢铁设备与外加直流电源的正极相连可以防止钢铁腐蚀 |
| C、甲烷燃料(KOH)电池的正极反应为:O2+2H2O+4e-=4OH- |
| D、粗铜精炼过程中,电路中每通过2mol电子,阳极就会溶解64g铜 |
考点:金属的电化学腐蚀与防护
专题:电化学专题
分析:A、电镀过程中电镀液浓度几乎不变;
B、电解池中阳极和电源正极连接,活性电极失电子发生氧化反应溶解;
C、燃料电池的正极上是氧气得电子的还原反应;
D、电解是将电能转化为化学能,电解精炼铜时,粗铜作阳极,粗铜中的铁、锌等杂质金属也会失电子溶解.
B、电解池中阳极和电源正极连接,活性电极失电子发生氧化反应溶解;
C、燃料电池的正极上是氧气得电子的还原反应;
D、电解是将电能转化为化学能,电解精炼铜时,粗铜作阳极,粗铜中的铁、锌等杂质金属也会失电子溶解.
解答:
A、电镀过程中电镀液浓度几乎不变,不需要经常更换,故A错误;
B、钢铁设备与外加直流电源的负极相连可以防止钢铁腐蚀,故B错误;
C、甲烷燃料(KOH)电池的正极上是氧气得电子的还原反应,电极反应为:O2+2H2O+4e-=4OH-,故C正确;
D、电解是将电能转化为化学能,电解精炼铜时,粗铜作阳极,粗铜中的铁、锌等杂质金属也会失电子溶解,故通过2mole-时,溶解的Cu的物质的量小于1mol,故阳极溶解铜的小于64g,故D错误.
故选C.
B、钢铁设备与外加直流电源的负极相连可以防止钢铁腐蚀,故B错误;
C、甲烷燃料(KOH)电池的正极上是氧气得电子的还原反应,电极反应为:O2+2H2O+4e-=4OH-,故C正确;
D、电解是将电能转化为化学能,电解精炼铜时,粗铜作阳极,粗铜中的铁、锌等杂质金属也会失电子溶解,故通过2mole-时,溶解的Cu的物质的量小于1mol,故阳极溶解铜的小于64g,故D错误.
故选C.
点评:本题考查电解原理及其应用,D选项为易错点,学生容易根据电镀分析,忽略粗铜的杂质会放电,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列各物质中,按熔点由高到低的顺序排列正确的是( )
| A、CH4>SiH4>GeH4>SnH4 |
| B、KCl>NaCl>NaF>LiF |
| C、Rb>K>Na>Li |
| D、金刚石>氯化钠>钠>干冰 |
下列有关物质用途的说法错误的是( )
| A、过氧化钠可用作潜水艇供氧剂 |
| B、氧化铝是一种耐火材料,可制耐高温实验材料 |
| C、氧化铁可用作红色油漆和涂料 |
| D、氢氧化铝、苏打等可用于治疗胃酸过多 |
硝酸工业的尾气中主要含有NO、NO2气体.下列关于它们的危害的叙述中,不正确的是( )
| A、NO、NO2是形成酸雨主要原因之一 |
| B、NO能在空气中稳定存在 |
| C、NO能跟血红蛋白作用引起中毒 |
| D、NO也能破坏臭氧层 |
在5KCl+KClO3+3H2SO4═3Cl2↑+3K2SO4+3H2O中,被氧化与被还原的氯原子的物质的量比为( )
| A、5:1 | B、1:5 |
| C、1:1 | D、3:1 |
关于如图所示装置的下列叙述,正确的是( )
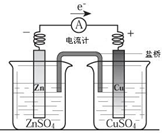

| A、电流方向是从锌片经导线流向铜片 |
| B、锌是阳极,锌片上有大量气泡产生 |
| C、铜离子在铜片表面被氧化,质量逐渐增大 |
| D、盐桥作用主要是离子通道和保持溶液电中性 |
某溶液中由水电离产生的c(H+)=1×10-10mol/L,该溶液的溶质不可能是( )
| A、KOH |
| B、KHSO4 |
| C、HCl |
| D、K2CO3 |
下列有关说法正确的是( )
| A、C.用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 |
| B、常温下,反应2A (s)+B (g)=2C (g)+D (g)不能自发进行,则该反应△H一定大于0 |
| C、N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大 |
| D、水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、标准状况下,22.4L水的分子数为NA |
| B、常温下将23gNa投入到0.5L1.0mol?L-1的盐酸中反应共转移的电子数为0.5NA |
| C、0.5mol/LKCl溶液中含有0.5NA个K+ |
| D、12.0g熔融的NaHSO4中含有0.1NA个阳离子 |