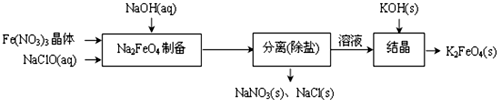
题目内容
下列说法中正确的是( )
| A、将58.5 g NaCl溶于1 L水中,所得溶液的物质的量浓度为1 mol/L |
| B、从1 L 2 mol/L的H2SO4溶液中取出0.5 L,所得溶液的浓度为1 mol/L |
| C、配制500 mL 0.5 mol/L的CuSO4溶液,需62.5 g胆矾 |
| D、中和100 g 19.6%的H2SO4溶液,需要NaOH 4 g |
考点:物质的量浓度的相关计算,化学方程式的有关计算
专题:
分析:A.将58.5 g NaCl物质的量为1mol,溶于水配成1 L溶液,所得溶液的物质的量浓度为1 mol/L;
B.溶液是均匀的,取出溶液浓度与原溶液浓度相等;
C.根据n=cV计算硫酸铜的物质的量,再根据m=nM计算胆矾的质量;
D.计算硫酸的质量,根据n=
硫酸的物质的量,中和硫酸需要n(NaOH)=2n(H2SO4),再根据m=nM计算NaOH的质量.
B.溶液是均匀的,取出溶液浓度与原溶液浓度相等;
C.根据n=cV计算硫酸铜的物质的量,再根据m=nM计算胆矾的质量;
D.计算硫酸的质量,根据n=
| m |
| M |
解答:
解:A.将58.5 g NaCl物质的量为1mol,溶于水配成1 L溶液,所得溶液的物质的量浓度为1 mol/L,溶液体积为1L,不是溶剂的体积,故A错误;
B.溶液是均匀的,取出0.5L溶液浓度与原溶液浓度相等为1mol/L,故B错误;
C.硫酸铜的物质的量为0.5L×0.5mol/L=0.25mol,需要胆矾的质量为0.25mol×250g/mol=62.5g,故C正确;
D.硫酸的质量为100g×19.6%=19.6g,硫酸的物质的量为
=0.2mol,中和硫酸需要n(NaOH)=2n(H2SO4)=0.2mol×2=0.4mol,需要NaOH的质量为0.4mol×40g/mol=16g,故D错误,
故选C.
B.溶液是均匀的,取出0.5L溶液浓度与原溶液浓度相等为1mol/L,故B错误;
C.硫酸铜的物质的量为0.5L×0.5mol/L=0.25mol,需要胆矾的质量为0.25mol×250g/mol=62.5g,故C正确;
D.硫酸的质量为100g×19.6%=19.6g,硫酸的物质的量为
| 19.6g |
| 98g/mol |
故选C.
点评:本题考查物质的量浓度有关计算,难度不大,注意对公式的理解,有利于基础知识的巩固.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
下列各组物质不属于同分异构体的是( )
| A、苯和环己烷 |
| B、邻氯甲苯和对氯甲苯 |
| C、丙醛(CH3CH2CHO)和丙烯醇(CH2=CHCH2OH) |
| D、苯甲醇和对甲基苯酚 |
硝酸工业的尾气中主要含有NO、NO2气体.下列关于它们的危害的叙述中,不正确的是( )
| A、NO、NO2是形成酸雨主要原因之一 |
| B、NO能在空气中稳定存在 |
| C、NO能跟血红蛋白作用引起中毒 |
| D、NO也能破坏臭氧层 |
关于如图所示装置的下列叙述,正确的是( )
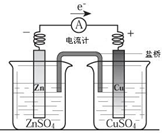

| A、电流方向是从锌片经导线流向铜片 |
| B、锌是阳极,锌片上有大量气泡产生 |
| C、铜离子在铜片表面被氧化,质量逐渐增大 |
| D、盐桥作用主要是离子通道和保持溶液电中性 |
某溶液中由水电离产生的c(H+)=1×10-10mol/L,该溶液的溶质不可能是( )
| A、KOH |
| B、KHSO4 |
| C、HCl |
| D、K2CO3 |
NaHCO3溶液中所含有的分子和离子有( )
①NaHCO3 ②H2O ③H2CO3 ④HCO3- ⑤H+ ⑥OH-⑦CO32-.
①NaHCO3 ②H2O ③H2CO3 ④HCO3- ⑤H+ ⑥OH-⑦CO32-.
| A、①②③ |
| B、②④⑤⑥ |
| C、②③④⑤⑥⑦ |
| D、①②③④⑤⑥⑦ |
下列有关说法正确的是( )
| A、C.用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 |
| B、常温下,反应2A (s)+B (g)=2C (g)+D (g)不能自发进行,则该反应△H一定大于0 |
| C、N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大 |
| D、水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |