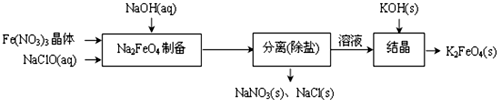
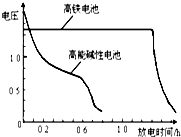
题目内容
下列表示对应化学反应的离子方程式正确的是( )
| A、铜与硝酸银溶液反应:Cu+Ag+=Cu2++Ag |
| B、氯气溶于水:Cl2+H2O?H++Cl-+HClO |
| C、硫酸溶液中滴加氢氧化钡溶液:H++SO42-+Ba2++OH-=H2O+BaSO4↓ |
| D、氯化钙溶液中通入二氧化碳气体:Ca2++CO2+H2O=CaCO3↓+2H+ |
考点:离子方程式的书写
专题:离子反应专题
分析:A.离子方程式两边正电荷不相等,不满足电荷守恒;
B.氯气与水反应生成氯化氢和次氯酸,次氯酸需要保留分子式;
C.氢离子、氢氧根离子的计量数不满足硫酸、氢氧化钡的化学式组成;
D.氯化钙溶液与二氧化碳气体不发生反应,无法写出反应的离子方程式.
B.氯气与水反应生成氯化氢和次氯酸,次氯酸需要保留分子式;
C.氢离子、氢氧根离子的计量数不满足硫酸、氢氧化钡的化学式组成;
D.氯化钙溶液与二氧化碳气体不发生反应,无法写出反应的离子方程式.
解答:
解:A.铜与硝酸银溶液反应生成银和硝酸铜,正确的离子方程式为:Cu+2Ag+=Cu2++2Ag,故A错误;
B.氯气溶于水,反应生成氯化氢、次氯酸,反应的离子方程式为:Cl2+H2O?H++Cl-+HClO,故B正确;
C.硫酸溶液中滴加氢氧化钡溶液反应生成硫酸钡和水,正确的离子方程式为:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓,故C错误;
D.氯化钙溶液中通入二氧化碳,二者不发生反应,无法写出离子方程式,故D错误;
故选B.
B.氯气溶于水,反应生成氯化氢、次氯酸,反应的离子方程式为:Cl2+H2O?H++Cl-+HClO,故B正确;
C.硫酸溶液中滴加氢氧化钡溶液反应生成硫酸钡和水,正确的离子方程式为:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓,故C错误;
D.氯化钙溶液中通入二氧化碳,二者不发生反应,无法写出离子方程式,故D错误;
故选B.
点评:本题考查了离子方程式的判断,为高考中的高频题,属于中等难度的试题,注意明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
硝酸工业的尾气中主要含有NO、NO2气体.下列关于它们的危害的叙述中,不正确的是( )
| A、NO、NO2是形成酸雨主要原因之一 |
| B、NO能在空气中稳定存在 |
| C、NO能跟血红蛋白作用引起中毒 |
| D、NO也能破坏臭氧层 |
下列有关说法正确的是( )
| A、C.用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 |
| B、常温下,反应2A (s)+B (g)=2C (g)+D (g)不能自发进行,则该反应△H一定大于0 |
| C、N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大 |
| D、水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
设NA为阿伏加德罗常数,如果ag某气体含分子数为P,则bg该气体在标准状况下的体积V(L)是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、标准状况下,22.4L水的分子数为NA |
| B、常温下将23gNa投入到0.5L1.0mol?L-1的盐酸中反应共转移的电子数为0.5NA |
| C、0.5mol/LKCl溶液中含有0.5NA个K+ |
| D、12.0g熔融的NaHSO4中含有0.1NA个阳离子 |