题目内容
中学化学实验中,淡黄色的pH试纸常用于测定溶液的酸碱性.在25℃时,若溶液的pH=7,试纸不变色;若pH<7,试纸变红色;若pH>7,试纸变蓝色.而要精确测定溶液的pH,需用pH计.pH计主要通过测定溶液中H+浓度来测定溶液的pH.
(1)已知水中存在如下平衡:H2O+H2O?H3O++OH-△H>0
现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是 (填字母).
A.向水中加入NaHSO4
B.向水中加入FeCl3
C.加热水至100℃[其中c(H+)=1×10-6 mol?L-1]
D.在水中加入CaO固体
(2)现欲测定100℃沸水的pH及酸碱性,若用pH试纸测定,则试纸显 色,溶液呈 (填“酸”、“碱”或“中”)性;若用pH计测定,则溶液呈 (填“酸”、“碱”或“中”)性.
(3)0.1mol?L-1HA酸pH=2,将其加入碳酸氢钠溶液中产生大量的二氧化碳气体,请写出HA与碳酸氢钠反应的离子方程式 .
(1)已知水中存在如下平衡:H2O+H2O?H3O++OH-△H>0
现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是
A.向水中加入NaHSO4
B.向水中加入FeCl3
C.加热水至100℃[其中c(H+)=1×10-6 mol?L-1]
D.在水中加入CaO固体
(2)现欲测定100℃沸水的pH及酸碱性,若用pH试纸测定,则试纸显
(3)0.1mol?L-1HA酸pH=2,将其加入碳酸氢钠溶液中产生大量的二氧化碳气体,请写出HA与碳酸氢钠反应的离子方程式
考点:弱电解质在水溶液中的电离平衡,pH的简单计算,酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:(1)使水的电离平衡向右移动的方法有:升高温度、加入含有弱根离子的盐等,如果溶液呈酸性,说明加入的物质和氢氧根离子反应,导致溶液中氢氧根离子浓度小于氢离子浓度而使溶液呈酸性;
(2)100℃沸水显示中性,根据中性环境下pH试纸的颜色来确定即可;在25℃时,水的pH=7,温度升高,则pH增大,水在任何温度下均为中性;
(3)0.1mol?L-1HA酸pH=2,则HA不完全电离,与碳酸氢钠反应生成二氧化碳与NaA.
(2)100℃沸水显示中性,根据中性环境下pH试纸的颜色来确定即可;在25℃时,水的pH=7,温度升高,则pH增大,水在任何温度下均为中性;
(3)0.1mol?L-1HA酸pH=2,则HA不完全电离,与碳酸氢钠反应生成二氧化碳与NaA.
解答:
解:(1)A.在水中加入NaHSO4,溶解后电离出氢离子,抑制水电离,平衡向左移动,且溶液中C(H+)>C(OH-),溶液呈酸性,故A错误;
B.向水中加入FeCl3,FeCl3是强酸弱碱盐能水解,铁离子和氢氧根离子结合生成氢氧化铁,从而促进水电离,导致溶液中C(OH-)<C(H+),溶液呈酸性,故B正确;
C.水的电离是吸热反应,加热至100℃,促进水电离,溶液C(OH-)=C(H+),溶液呈中性,故错误;
D.在水中加入CaO固体,CaO与水反应生成氢氧化钙,溶液为强碱性,氢氧根离子抑制水电离,平衡逆向移动,故D错误;
故答案为:B;
(2)100℃沸水仍然是中性的,pH试纸测定溶液的酸碱性时,中性溶液不变色,所以是淡黄色的,温度升高会促进水的电离,所以水的pH会减小,水在任何温度下均为中性的,若用pH计测定,则溶液呈中性;
故答案为:淡黄;中;中;
(3)0.1mol?L-1HA酸pH=2,则HA不完全电离,与碳酸氢钠反应生成二氧化碳与NaA,其离子方程式为:HCO3-+HA=H2O+CO2+A-;
故答案为:HCO3-+HA=H2O+CO2+A-.
B.向水中加入FeCl3,FeCl3是强酸弱碱盐能水解,铁离子和氢氧根离子结合生成氢氧化铁,从而促进水电离,导致溶液中C(OH-)<C(H+),溶液呈酸性,故B正确;
C.水的电离是吸热反应,加热至100℃,促进水电离,溶液C(OH-)=C(H+),溶液呈中性,故错误;
D.在水中加入CaO固体,CaO与水反应生成氢氧化钙,溶液为强碱性,氢氧根离子抑制水电离,平衡逆向移动,故D错误;
故答案为:B;
(2)100℃沸水仍然是中性的,pH试纸测定溶液的酸碱性时,中性溶液不变色,所以是淡黄色的,温度升高会促进水的电离,所以水的pH会减小,水在任何温度下均为中性的,若用pH计测定,则溶液呈中性;
故答案为:淡黄;中;中;
(3)0.1mol?L-1HA酸pH=2,则HA不完全电离,与碳酸氢钠反应生成二氧化碳与NaA,其离子方程式为:HCO3-+HA=H2O+CO2+A-;
故答案为:HCO3-+HA=H2O+CO2+A-.
点评:本题考查了水的电离平衡和溶液酸碱性的关系,题目难度不大,注意从题干中提取pH试纸的使用的有效信息.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
当光束通过下列分散系时,能产生丁达尔效应的是( )
| A、硫酸铜溶液 |
| B、氯化铁溶液 |
| C、氢氧化铁胶体 |
| D、氯化钠溶液 |
T℃时在2L容积不变的密闭容器中使X(g)与Y(g)发生反应生成Z(g).反应过程中X、Y、Z的浓度变化如图1所示.则下列结论正确的是( )
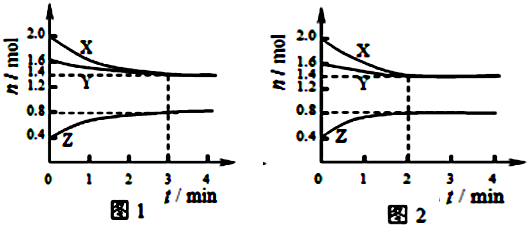

| A、容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g) |
| B、反应进行前3min内,用X表示的反应速率v(X)=0.1mol/(L?min) |
| C、若改变反应条件,使反应进程如图2所示,则改变的条件是增大压强 |
| D、如图1所示,该反应达到化学平衡时,X的转化率为70% |
通以相等的电量,分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银):n(硝酸亚汞)=2:1,则下列叙述正确的是( )
| A、电解后溶液的pH都增大 |
| B、在两个阳极上得到的产物的物质的量不相等 |
| C、硝酸亚汞的分子式为Hg2(NO3)2 |
| D、在两个阴极上得到的银和汞的物质的量之比为2:1 |
有关晶体的叙述中,错误的是( )
| A、区分晶体和非晶体最可靠的科学方法是对固体进行X-射线衍射实验 |
| B、晶体与非晶体的本质区别在于是否具有规则的几何外形 |
| C、分子晶体熔化时,不破坏共价键;原子晶体熔化时,破坏共价键 |
| D、在金属铜的晶体中,由于存在自由电子,因此铜能导电 |
下列各物质中,按熔点由高到低的顺序排列正确的是( )
| A、CH4>SiH4>GeH4>SnH4 |
| B、KCl>NaCl>NaF>LiF |
| C、Rb>K>Na>Li |
| D、金刚石>氯化钠>钠>干冰 |
下列各组物质不属于同分异构体的是( )
| A、苯和环己烷 |
| B、邻氯甲苯和对氯甲苯 |
| C、丙醛(CH3CH2CHO)和丙烯醇(CH2=CHCH2OH) |
| D、苯甲醇和对甲基苯酚 |
硝酸工业的尾气中主要含有NO、NO2气体.下列关于它们的危害的叙述中,不正确的是( )
| A、NO、NO2是形成酸雨主要原因之一 |
| B、NO能在空气中稳定存在 |
| C、NO能跟血红蛋白作用引起中毒 |
| D、NO也能破坏臭氧层 |
