题目内容
 电化学与生产生活密切相关.请运用相关知识回答下列问题:
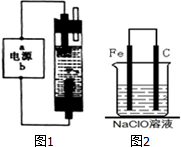
电化学与生产生活密切相关.请运用相关知识回答下列问题:(1)如图1为某同学设计的装置,用石墨作电极电解饱和氯化钠溶液制备家用环保型消毒液(NaClO溶液)发生器.
若通电时,为使生成的Cl2被完全吸收,制得有较强杀菌能力的消毒液,
则电源的a电极名称为
装置溶液中反应生成NaClO的离子方程式为:
(2)该消毒液还具有的化学性质是
A.强氧化性 B.强还原性 C.不稳定性 D.漂白性E.弱酸性
(3)设计方案,对该消毒液对碳钢制品的腐蚀原理实施探究.
①用烧杯取少量样品,将一颗光亮的普通碳钢钉放入烧杯,浸泡一段时间.预期的实验现象是
②为了进一步探究铁钉在该漂白剂(NaClO)溶液中的腐蚀原理,现设计了如图2实验装置,请写出碳(C)极上发生的电极反应式:
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)由装置图可知上端应生成氢气,则a为负极,在电解池的阴极上是阳离子得电子发生得电子的还原反应,在阳极上是阴离子发生失电子的氧化反应;氯气可以和强碱反应生成氯化钠、次氯酸钠和水;
(2)该消毒液的有效成分为NaClO;
(3)①用烧杯取少量样品,将一颗光亮的普通碳钢钉放入烧杯,可发生电化学腐蚀;
②碳为正极,发生还原反应.
(2)该消毒液的有效成分为NaClO;
(3)①用烧杯取少量样品,将一颗光亮的普通碳钢钉放入烧杯,可发生电化学腐蚀;
②碳为正极,发生还原反应.
解答:
解:(1)用石墨作电极电解饱和氯化钠溶液,若通电时,为使生成的Cl2被完全吸收,制得有较强杀菌能力的消毒液,则电解池的下端产生的是氯气,上端产生的是氢气,电解池的阴极上是阳离子氢离子得电子发生得电子的还原反应,生成氢气,在阳极上是阴离子氯离子发生失电子的氧化反应,生成氯气,所以a是正极,b是负极,氯气和氢氧化钠反应的实质是:Cl2+2OH-═Cl-+ClO-+H2O,
故答案为:负; Cl2+2OH-=Cl-+ClO-+H2O;
(2)在消毒液中,次氯酸钠具有氧化性,还具有漂白性,故答案为:AD;
(3)①在此情况下发生金属铁的吸氧腐蚀,最终会生成氢氧化铁沉淀,故答案为:钢钉表面有红褐色物质生成;
②在该原电池装置中,金属铁为负极,碳棒上发生得电子的还原反应,即ClO-+2e-+H2O→Cl-+2OH-,故答案为:ClO-+2e-+H2O=Cl-+2OH-.
故答案为:负; Cl2+2OH-=Cl-+ClO-+H2O;
(2)在消毒液中,次氯酸钠具有氧化性,还具有漂白性,故答案为:AD;
(3)①在此情况下发生金属铁的吸氧腐蚀,最终会生成氢氧化铁沉淀,故答案为:钢钉表面有红褐色物质生成;
②在该原电池装置中,金属铁为负极,碳棒上发生得电子的还原反应,即ClO-+2e-+H2O→Cl-+2OH-,故答案为:ClO-+2e-+H2O=Cl-+2OH-.
点评:本题主要考查了电解池的原理的应用,为高频考点,侧重于学生的分析能力的考查,明确发生的电极反应及“使Cl2被完全吸收,制得有较强杀菌能力的消毒液”即可解答,题目难度不大.

练习册系列答案
相关题目
通以相等的电量,分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银):n(硝酸亚汞)=2:1,则下列叙述正确的是( )
| A、电解后溶液的pH都增大 |
| B、在两个阳极上得到的产物的物质的量不相等 |
| C、硝酸亚汞的分子式为Hg2(NO3)2 |
| D、在两个阴极上得到的银和汞的物质的量之比为2:1 |
下列有机物结构中,核磁共振氢谱不可能只有一个峰值的是( )
| A、C3H4 |
| B、C3H6 |
| C、C3H8 |
| D、C5H12 |
下列有关物质用途的说法错误的是( )
| A、过氧化钠可用作潜水艇供氧剂 |
| B、氧化铝是一种耐火材料,可制耐高温实验材料 |
| C、氧化铁可用作红色油漆和涂料 |
| D、氢氧化铝、苏打等可用于治疗胃酸过多 |
硝酸工业的尾气中主要含有NO、NO2气体.下列关于它们的危害的叙述中,不正确的是( )
| A、NO、NO2是形成酸雨主要原因之一 |
| B、NO能在空气中稳定存在 |
| C、NO能跟血红蛋白作用引起中毒 |
| D、NO也能破坏臭氧层 |
在5KCl+KClO3+3H2SO4═3Cl2↑+3K2SO4+3H2O中,被氧化与被还原的氯原子的物质的量比为( )
| A、5:1 | B、1:5 |
| C、1:1 | D、3:1 |
某溶液中由水电离产生的c(H+)=1×10-10mol/L,该溶液的溶质不可能是( )
| A、KOH |
| B、KHSO4 |
| C、HCl |
| D、K2CO3 |
设NA为阿伏加德罗常数,如果ag某气体含分子数为P,则bg该气体在标准状况下的体积V(L)是( )
A、
| ||
B、
| ||
C、
| ||
D、
|