题目内容
4.下列各组顺序的排列不正确的是( )| A. | 原子半径:Na>Mg>Al | B. | 热稳定性:HCl<H2S<PH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H3PO4 | D. | 熔点:NaCl>H2O>CO2 |
分析 A.同周期从左向右,原子半径减小;
B.同周期从左向右,非金属性增强,非金属性强的对应氢化物稳定;
C.同周期从左向右,非金属性增强,非金属性强的对应最高价含氧酸的酸性强;
D.一般来说,熔点为离子晶体>分子晶体,水中含氢键,熔点大于二氧化碳.
解答 解:A.同周期从左向右,原子半径减小,则原子半径:Na>Mg>Al,故A正确;
B.同周期从左向右,非金属性增强,非金属性强的对应氢化物稳定,则热稳定性:HCl>H2S>PH3,故B错误;
C.同周期从左向右,非金属性增强,非金属性强的对应最高价含氧酸的酸性强,则酸性强弱:H2SiO3<H2CO3<H3PO4,故C正确;
D.一般来说,熔点为离子晶体>分子晶体,水中含氢键,熔点大于二氧化碳,则熔点:NaCl>H2O>CO2,故D正确;
故选B.
点评 本题考查周期表和周期律的综合应用,为高频考点,把握元素的位置、元素的性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
19.下列叙述中正确的是( )
| A. | 只含离子键的化合物才是离子晶体 | |
| B. | (NH4)2SO4晶体是含有离子建、共价键和配位键的分子晶体 | |
| C. | 由于I-I中的共价键键比F-F、Cl-Cl、Br-Br都弱,因此在卤素单质中I2的熔点、沸点最低 | |
| D. | 分子晶体中一定不存在离子键,而离子晶体中可能存在共价键 |
9.某元素二价阳离子的核外有18个电子,质量数为40,则该原子原子核中的中子数为( )
| A. | 16 | B. | 18 | C. | 20 | D. | 24 |
16.a g下列物质在氧气中充分燃烧后的气体(1.01×105Pa,120℃),通过足量的过氧化钠充分反应后,过氧化钠增重b g,符合b>a 的选项有( )
| A. | HCHO | B. | CH3COOCH2CH3 | C. | HOOCCOOH | D. | CH3COOH |
13.某烃的一种同分异构体与Cl2反应生成的一氯代物只有一种,该烃是( )
| A. | C3H8 | B. | C4H10 | C. | C5H12 | D. | C6H14 |
14.下列关于乙烯和乙烷的说法正确的是( )
| A. | 乙烯可以使溴水褪色 | |
| B. | 乙烯制备聚乙烯是物理变化 | |
| C. | 乙烷和乙烯互为同分异构体 | |
| D. | 乙烷可与氯气反应制取纯净的一氯乙烷 |
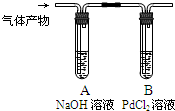 黑火药爆炸时发生多种化学反应,其中主要化学反应方程式为:
黑火药爆炸时发生多种化学反应,其中主要化学反应方程式为: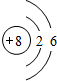 .
.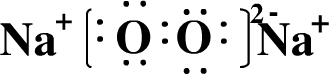 .
. .
.