题目内容
19.下列叙述中正确的是( )| A. | 只含离子键的化合物才是离子晶体 | |
| B. | (NH4)2SO4晶体是含有离子建、共价键和配位键的分子晶体 | |
| C. | 由于I-I中的共价键键比F-F、Cl-Cl、Br-Br都弱,因此在卤素单质中I2的熔点、沸点最低 | |
| D. | 分子晶体中一定不存在离子键,而离子晶体中可能存在共价键 |
分析 A.离子化合物中一定含离子键;
B.硫酸铵中含有离子键、极性共价键和配位键;
C.分子晶体的熔沸点与相对分子质量成正比;
D.分子晶体中一定不含离子键,含有离子键的晶体属于离子晶体.
解答 解:A.离子化合物中一定含离子键,可能还含共价键,故A错误;
B.硫酸铵中铵根离子和硫酸根离子之间存在离子键,氮原子和氢原子之间存在共价键和配位键,属于离子晶体,故B错误;
C.分子晶体的熔沸点与相对分子质量成正比,碘分子的相对分子质量比氟气、氯气和溴的大,所以其熔沸点最高,故C错误;
D.分子晶体中一定不含离子键,含有离子键的晶体属于离子晶体,离子晶体中可能含有共价键,如NaOH属于离子晶体,含有共价键,故D正确;
故选D.
点评 本题考查化学键与化合物的类型,注意利用实例分析选项,把握特殊物质中的化学键及稀有气体中不含化学键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.如图1为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
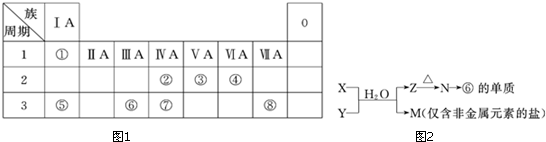
(1)地壳中含量居于第二位的元素在周期表中的位置是第三周期第ⅣA族.
(2)②、⑦的最高价含氧酸的酸性是由强到弱的,用原子结构解释原因:同主族自上而下电子层增大,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱.
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的离子化合物,写出其中一种化合物的电子式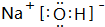 .
.
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,下列物质不能做该反应催化剂的是(填序号)c.
a.MnO2 b.CuSO4 c.Na2SO3 d.FeCl3
(5)W与④是相邻的同主族元素.在下表中列出H2WO3的各种不同化学性质,举例并写出相应的化学方程式.
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生图2反应:
X溶液与Y溶液反应的离子方程式Al3++3NH3+3H2O═Al(OH)3↓+3NH4+,
N→⑥的单质的化学方程式为2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,
M溶液中离子浓度由大到小的排列顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-)或c(NO3-)>c(NH4+)>c(H+)>c(OH-),
M中阳离子的鉴定方法取少量M样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子.

(1)地壳中含量居于第二位的元素在周期表中的位置是第三周期第ⅣA族.
(2)②、⑦的最高价含氧酸的酸性是由强到弱的,用原子结构解释原因:同主族自上而下电子层增大,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱.
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的离子化合物,写出其中一种化合物的电子式
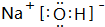 .
.(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,下列物质不能做该反应催化剂的是(填序号)c.
a.MnO2 b.CuSO4 c.Na2SO3 d.FeCl3
(5)W与④是相邻的同主族元素.在下表中列出H2WO3的各种不同化学性质,举例并写出相应的化学方程式.
| 编号 | 性质 | 化学方程式 |
| 示例 | 氧化性 | H2WO3+3H3PO3═3H3PO4+H2W↑ |
| 1 | 还原性 | H2SO3+Br2+2H2O═H2SO3+2HBr |
| 2 | 酸性 | H2SO3+2NaOH═Na2SO3+2H2O |
X溶液与Y溶液反应的离子方程式Al3++3NH3+3H2O═Al(OH)3↓+3NH4+,
N→⑥的单质的化学方程式为2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,
M溶液中离子浓度由大到小的排列顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-)或c(NO3-)>c(NH4+)>c(H+)>c(OH-),
M中阳离子的鉴定方法取少量M样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子.
14.可以将反应Zn+Br2=ZnBr2设计成蓄电池,下列表示放电时的负极反应的是( )
| A. | Zn-2e-=Zn2+ | B. | Br2+2e-=2Br- | C. | 2Br--2e-=Br2 | D. | Zn2++2e-=Zn |
4.下列各组顺序的排列不正确的是( )
| A. | 原子半径:Na>Mg>Al | B. | 热稳定性:HCl<H2S<PH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H3PO4 | D. | 熔点:NaCl>H2O>CO2 |
11.下列各元素的氧化物中,既能与盐酸反应,又能与NaOH溶液反应的是( )
| A. | 元素X:它的原子中第三电子层比第二电子层少2个电子 | |
| B. | 元素Y:它的二价阳离子核外电子总数与氩原子相同 | |
| C. | 元素Z:位于元素周期表中的第3周期,ⅢA族 | |
| D. | 元素W:它的单质硬度最大 |
8.在下列元素中,不属于主族元素的是( )
| A. | p | B. | Fe | C. | Ca | D. | I |
9.如表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为 .
.
(2)表中能形成两性氢氧化物的元素是Al(用元素符号表示),写出该元素的单质与⑨最高价氧化物对应水化物反应的化学方程式2Al+2KOH+2H2O═2KAlO2+3H2↑.
(3)元素⑥、⑦氢化物的稳定性顺序为HCl>H2S (填写化学式);
(4)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入如表.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.(2)表中能形成两性氢氧化物的元素是Al(用元素符号表示),写出该元素的单质与⑨最高价氧化物对应水化物反应的化学方程式2Al+2KOH+2H2O═2KAlO2+3H2↑.
(3)元素⑥、⑦氢化物的稳定性顺序为HCl>H2S (填写化学式);
(4)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入如表.
| 实验步骤 | 实验现象 | 结论与化学反应方程式 |
 回答下列问题:
回答下列问题: 原子序数依次递增且都小于36的A、B、C、D、E五种元素,其中A的一种核素中没有中子,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍.回答下列问题:
原子序数依次递增且都小于36的A、B、C、D、E五种元素,其中A的一种核素中没有中子,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍.回答下列问题: