题目内容
14.下列关于乙烯和乙烷的说法正确的是( )| A. | 乙烯可以使溴水褪色 | |
| B. | 乙烯制备聚乙烯是物理变化 | |
| C. | 乙烷和乙烯互为同分异构体 | |
| D. | 乙烷可与氯气反应制取纯净的一氯乙烷 |
分析 A.乙烯中含有碳碳双键,性质较活泼,能发生加成反应、加聚反应和氧化反应,乙烷性质较稳定,和强酸、强碱和强氧化剂不反应(氧气除外);
B.有新物质生成的反应为化学反应;
C.分子式相同、结构不同的有机物互称同分异构体;
D.乙烷和氯气发生取代反应时生成多种氯代烃.
解答 解:A.乙烯中含有碳碳双键,性质较活泼,能发生加成反应、加聚反应和氧化反应,乙烷性质较稳定,和强酸、强碱和强氧化剂不反应(氧气除外),所以乙烯能和溴发生加成反应生成1,2-二溴乙烷,乙烷不反应,故A正确;
B.有新物质生成的反应为化学反应,所以乙烯发生加聚反应生成聚乙烯为化学反应,故B错误;
C.分子式相同、结构不同的有机物互称同分异构体,二者分子式不同,不是同分异构体,故C错误;
D.乙烷和氯气发生取代反应时生成多种氯代烃,乙烯和HCl发生加成反应生成氯乙烯,故D错误;
故选A.
点评 本题考查有机物结构和性质及基本概念,为高频考点,明确乙烯、乙烷结构差异性及基本概念是解本题关键,碳碳双键的存在导致烯烃性质较活泼.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.下列各组顺序的排列不正确的是( )
| A. | 原子半径:Na>Mg>Al | B. | 热稳定性:HCl<H2S<PH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H3PO4 | D. | 熔点:NaCl>H2O>CO2 |
5.下列用电子式表示化合物的形成过程正确的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
2.下列物质的水溶液经加热浓缩,蒸干灼烧仍能得到原物质的是( )
| A. | FeCl3 | B. | Na2CO3 | C. | Na2SO3 | D. | Cu(NO3)2 |
9.如表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为 .
.
(2)表中能形成两性氢氧化物的元素是Al(用元素符号表示),写出该元素的单质与⑨最高价氧化物对应水化物反应的化学方程式2Al+2KOH+2H2O═2KAlO2+3H2↑.
(3)元素⑥、⑦氢化物的稳定性顺序为HCl>H2S (填写化学式);
(4)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入如表.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.(2)表中能形成两性氢氧化物的元素是Al(用元素符号表示),写出该元素的单质与⑨最高价氧化物对应水化物反应的化学方程式2Al+2KOH+2H2O═2KAlO2+3H2↑.
(3)元素⑥、⑦氢化物的稳定性顺序为HCl>H2S (填写化学式);
(4)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入如表.
| 实验步骤 | 实验现象 | 结论与化学反应方程式 |
6.如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法正确的是( )
| X | Y | ||
| W | Z | ||
| T |
| A. | X、Y、Z三种元素最低价氢化物的沸点依次升高 | |
| B. | T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4 | |
| C. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| D. | 物质WY2、W3X4、WZ4均有熔点高、硬度小的特性 |
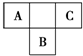 A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.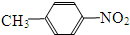 和
和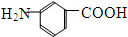 E、35Cl和37Cl
E、35Cl和37Cl