题目内容
12.磷酸铁(FePO4•2H2O)是合成磷酸铁锂的前驱体.以绿矾(FeSO4•7H2O)为原料合成磷酸铁的流程如图所示.
回答下列问题:
(1)在溶解与酸化反应器中需控制$\frac{n(FeS{O}_{4}•7{H}_{2}O)}{n({H}_{3}P{O}_{4})}$为1:3.5,其目的是:
①保证其pH=1.8;
②PO43-过量有利于析出FePO4,避免Fe3+以其它形式沉淀,提高FePO4的纯度
(2)氧化釜中Fe2+被氧化的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)在沉淀釜中加碱需控制溶液的pH≤2.2.
①pH偏大时,产品的质量较差,其原因为pH过大时主要生成氢氧化铁沉淀(已知Ksp(FePO4)=1.3×10-22,Ksp[Fe(OH)3]=2.8×10-39)
②生成FePO4•2H2O沉淀的离子方程式为Fe3++H3OP4+2OH-=FePO4•2H2O↓+H2O
(4)陈化釜中陈化的目的是使小晶粒逐渐溶解,大晶粒逐渐长大,提高沉淀的纯度.
(5)合成磷酸亚铁锂(LiFePO4)的步骤如下:
球磨罐中加入适量蒸馏水,再加入一定量的氢氧化锂和一定量的蔗糖使其溶解,用醋酸调节pH到9.0,最后加入一定量的FePO4•2H2O,球磨7h,再经干燥,在700℃和氮气的氛围下煅烧,最后得磷酸亚铁锂.已知:首先发生反应C12H22O11→12C+11H2O.
①球磨的目的是减小FePO4•2H2O颗粒大小,有利于反应物混合均匀.
②需在氮气氛围下进行反应的原因是隔绝空气,防止二价铁被氧化.
③写出FePO4生成LiFePO4的化学方程式:2FePO4+2LiOH+C$\frac{\underline{\;\;\;\;\;N_{2}\;\;\;\;\;}}{700℃}$2LiFePO4+CO↑+2H2O.
(6)若测得(5)得到的产品中n(Li):n(Fe):n(P)=0.8:1:1,则产品中$\frac{n(F{e}^{2+})}{n(F{e}^{3+})}$=4:1.
分析 绿矾用磷酸溶解和酸化,用过氧化氢将Fe2+氧化为Fe3+,进入氢氧化钠调节pH,析出FePO4•2H2O沉淀,再经过离心分离机分离,磷酸循环利用,经过干燥粉碎得到产品,陈化釜中也是得到FePO4•2H2O,陈化过程是进行提纯.
(1)在溶解与酸化反应器中需控制$\frac{n(FeS{O}_{4}•7{H}_{2}O)}{n({H}_{3}P{O}_{4})}$为1:3.5,其目的是:①保证其pH=1.8;②增大磷酸根的浓度,有利于析出FePO4,避免Fe3+以其它形式沉淀;
(2)酸性条件下过氧化氢将Fe2+氧化为Fe3+,同时生成水;
(3)①pH过大,会生成氢氧化铁沉淀;
②加入氢氧化钠与磷酸反应生成磷酸钠与水,磷酸根与铁离子、水反应生成FePO4•2H2O沉淀;
(4)使小晶粒逐渐溶解,大晶粒逐渐长大,提高沉淀的纯度;
(5)①球磨时晶体颗粒减小,有利于反应物混合均匀;
②防止二价铁被氧化;
③由题目信息,可知FePO4与LiOH、C反应生成LiFePO4、CO与水;
(6)根据化合价代数和为0,结合原子数目关系列方程计算.
解答 解:绿矾用磷酸溶解和酸化,用过氧化氢将Fe2+氧化为Fe3+,进入氢氧化钠调节pH,析出FePO4•2H2O沉淀,再经过离心分离机分离,磷酸循环利用,经过干燥粉碎得到产品,陈化釜中也是得到FePO4•2H2O,陈化过程是进行提纯.
(1)在溶解与酸化反应器中需控制$\frac{n(FeS{O}_{4}•7{H}_{2}O)}{n({H}_{3}P{O}_{4})}$为1:3.5,其目的是:①保证其pH=1.8;②PO43-过量有利于析出FePO4,避免Fe3+以其它形式沉淀,提高FePO4的纯度,
故答案为:PO43-过量有利于析出FePO4,避免Fe3+以其它形式沉淀,提高FePO4的纯度;
(2)酸性条件下过氧化氢将Fe2+氧化为Fe3+,同时生成水,反应离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)①pH过大时主要生成氢氧化铁沉淀,产品的质量较差,
故答案为:pH过大时主要生成氢氧化铁沉淀;
②加入氢氧化钠与磷酸反应生成磷酸钠与水,磷酸根与铁离子、水反应生成FePO4•2H2O沉淀,整个过程反应方程式为:Fe3++H3OP4+2OH-=FePO4•2H2O↓+H2O,
故答案为:Fe3++H3OP4+2OH-=FePO4•2H2O↓+H2O;
(4)陈化釜中陈化的目的是:使小晶粒逐渐溶解,大晶粒逐渐长大,提高沉淀的纯度,
故答案为:使小晶粒逐渐溶解,大晶粒逐渐长大,提高沉淀的纯度;
(5)①球磨的目的是:减小FePO4•2H2O颗粒大小,有利于反应物混合均匀,
故答案为:减小FePO4•2H2O颗粒大小,有利于反应物混合均匀;
②需在氮气氛围下进行反应的原因是:隔绝空气,防止二价铁被氧化,
故答案为:隔绝空气,防止二价铁被氧化;
③由题目信息,可知FePO4与LiOH、C反应生成LiFePO4、CO与水,反应方程式为:2FePO4+2LiOH+C$\frac{\underline{\;\;\;\;\;N_{2}\;\;\;\;\;}}{700℃}$2LiFePO4+CO↑+2H2O,
故答案为:2FePO4+2LiOH+C$\frac{\underline{\;\;\;\;\;N_{2}\;\;\;\;\;}}{700℃}$2LiFePO4+CO↑+2H2O;
(6)产品中n(Li):n(Fe):n(P)=0.8:1:1,
根据化合价代数和为0,可知0.8×1+2n(Fe2+)+3n(Fe3+)=1×3,
而n(Fe2+)+n(Fe3+)=1,
联立解得n(Fe2+)=0.8,n(Fe3+)=0.2,
故n(Fe2+):n(Fe3+)=0.8:0.2=4:1,
故答案为:4:1.
点评 本题考查属于化学与技术,涉及物质的制备、陌生方程式的书写、条件的控制、对操作的分析评价、物质的提纯等,侧重对原理的分析、信息获取与迁移运用能力的考查.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | X与Y形成化合物时,X显负价,Y显正价 | |
| B. | 电负性X>Y | |
| C. | 最高价含氧酸的酸性:X对应的酸性弱于Y对应的酸性 | |
| D. | 失去第一个电子消耗能量:X>Y |
| A. | 原子半径:Na>Mg>Al | B. | 热稳定性:HCl<H2S<PH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H3PO4 | D. | 熔点:NaCl>H2O>CO2 |
| A. | FeCl3 | B. | Na2CO3 | C. | Na2SO3 | D. | Cu(NO3)2 |
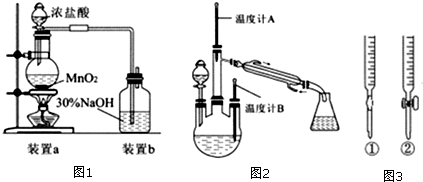
 某兴趣小组探究SO2气体还原Fe3+、I2,它们使用的药品和装置如图所示
某兴趣小组探究SO2气体还原Fe3+、I2,它们使用的药品和装置如图所示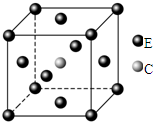 原子序数依次递增且都小于36的A、B、C、D、E五种元素,其中A的一种核素中没有中子,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍.回答下列问题:
原子序数依次递增且都小于36的A、B、C、D、E五种元素,其中A的一种核素中没有中子,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍.回答下列问题: