题目内容
15.A、B、C、D四种短周期元素,A、B同主族,C、D同周期.气体A2与气体C2按体积比2:1混合后点燃能够发生爆炸,且产物在常温常压下是一种无色无味的液体.B的阳离子与C的-2价阴离子的核外电子排布相同.D能形成自然界硬度最大的单质.请根据上述所提供的信息回答下列问题.(1)写出A、B、C三种元素的元素符号:AH、BNa、CO;D在周期表中的位置是第二周期第ⅣA族.
(2)写出化合物B2C2的电子式
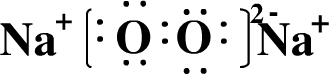 .
.(3)写出B2C2和A2C反应的离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑.
(4)用电子式表示A2C形成的过程:
 .
.
分析 A、B、C、D四种短周期元素,气体A2与气体C2按体积比2:1混和后点燃能够发生爆炸,且产物在常温常压下是一种无色无味的液体,该液体应为水,则可推知A为H,C为O,C、D同周期,D能形成自然界硬度最大的单质,则D为C,A、B同主族,B的阳离子与C的阴离子的核外电子排布相同,则B为Na,据此答题.
解答 解:A、B、C、D四种短周期元素,气体A2与气体C2按体积比2:1混和后点燃能够发生爆炸,且产物在常温常压下是一种无色无味的液体,该液体应为水,则可推知A为H,C为O,C、D同周期,D能形成自然界硬度最大的单质,则D为C,A、B同主族,B的阳离子与C的阴离子的核外电子排布相同,则B为Na,
(1)根据上面的分析可知,A为氢元素,B为氧元素,C为氧元素,D为C,在周期表中的位置是第二周期第ⅣA族,故答案为:H;Na;O;第二周期第ⅣA族;
(2)B2C2为Na2O2,是离子化合物,其电子式为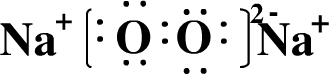 ,故答案为:
,故答案为: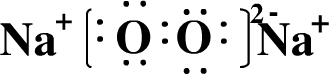 ;
;
(3)Na2O2和H2O生成NaOH和O2,离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑,故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑;
(4)H2O为共价化合物,各原子达到稳定结构,用电子式表示形成过程为 ,故答案为:
,故答案为: .
.
点评 本题考查位置、结构、性质的关系及应用,为高频考点,元素的推断为解答的关键,侧重分析、推断能力的考查,题目难度不大.

练习册系列答案
相关题目
5.某学习研究小根据金属锌、铝、铁分别与稀盐酸反应的相对速率,探究金属锌、铝、铁的金属活动性和反应速率测定.
【实验设计】为了达到实验目的,必须控制实验条件.你认为控制的实验条件是(可填满也可不填满)
(1)反应体系的温度(相同);(2)盐酸的浓度(相同);(3)取用盐酸的体积(相同);(4)金属的(比)表面积(或金属粉末的粗细程度)(相同).
【实验探究】该学习研究小组在上述实验条件相同的情况下,进行三组实验:各量取50mL稀盐酸于小烧杯中,分别同时加入足量的三种表面无氧化膜的金属片,用pH计测定溶液的pH并将信息传输到电脑,电脑动态地绘制出溶液中c(H+)随时间t的变化曲线(反应过程中溶液的体积没有变化).图1是反应到t1s时电脑记录的曲线:
【交流与表达】根据上述c(H+)随时间t的变化曲线回答下列问题: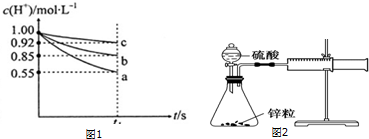
(1)表示金属活动性最弱的金属与H+反应的变化曲线是c(填“a”、“b”或“c”编号).
(2)在同一时间内,表示不同反应的反应速率可以有:同温同压下放出氢气的体积V(H2);溶液中H+浓度的减少△c(H+);固体减少的量△m或△n.在0一t1s之间,设A1和Zn分别与盐酸反应的速率为v(Al)和v(Zn):
Ⅰ.若以溶液中c(H+)减少来表示不同反应的速率,即v(Al):v(Zn)═3:1;
Ⅱ.若以固体质量的减轻来表示不同反应的速率,即v(Al):v(Zn)═54:65;
Ⅲ.若以固体物质的量减少来表示不同反应的速率,即v(Al):v(Zn)═2:1.
IV.可以利用图2所示的装置测定不同浓度的硫酸与锌的反应速率,请回答下列问题:
按照上述装置图安装3套相同的装置,并检验装置气密性良好,将注射器的活栓推至“0”刻度处;然后在三个锥形瓶中分别放入相同形状的锌粒2g,并分别通过分液漏斗在锥形瓶中加入1mol•L-1、2mol•L-1和4mol•L-1的稀硫酸40mL.请补全下表空白:
请选择一组合适的数据填写在第②组实验中的a、b处B.
A.12和0.83B.6和1.67C.1和10D.6和3.67.
【实验设计】为了达到实验目的,必须控制实验条件.你认为控制的实验条件是(可填满也可不填满)
(1)反应体系的温度(相同);(2)盐酸的浓度(相同);(3)取用盐酸的体积(相同);(4)金属的(比)表面积(或金属粉末的粗细程度)(相同).
【实验探究】该学习研究小组在上述实验条件相同的情况下,进行三组实验:各量取50mL稀盐酸于小烧杯中,分别同时加入足量的三种表面无氧化膜的金属片,用pH计测定溶液的pH并将信息传输到电脑,电脑动态地绘制出溶液中c(H+)随时间t的变化曲线(反应过程中溶液的体积没有变化).图1是反应到t1s时电脑记录的曲线:
【交流与表达】根据上述c(H+)随时间t的变化曲线回答下列问题:

(1)表示金属活动性最弱的金属与H+反应的变化曲线是c(填“a”、“b”或“c”编号).
(2)在同一时间内,表示不同反应的反应速率可以有:同温同压下放出氢气的体积V(H2);溶液中H+浓度的减少△c(H+);固体减少的量△m或△n.在0一t1s之间,设A1和Zn分别与盐酸反应的速率为v(Al)和v(Zn):
Ⅰ.若以溶液中c(H+)减少来表示不同反应的速率,即v(Al):v(Zn)═3:1;
Ⅱ.若以固体质量的减轻来表示不同反应的速率,即v(Al):v(Zn)═54:65;
Ⅲ.若以固体物质的量减少来表示不同反应的速率,即v(Al):v(Zn)═2:1.
IV.可以利用图2所示的装置测定不同浓度的硫酸与锌的反应速率,请回答下列问题:
按照上述装置图安装3套相同的装置,并检验装置气密性良好,将注射器的活栓推至“0”刻度处;然后在三个锥形瓶中分别放入相同形状的锌粒2g,并分别通过分液漏斗在锥形瓶中加入1mol•L-1、2mol•L-1和4mol•L-1的稀硫酸40mL.请补全下表空白:
| 序号 | 加入的稀硫酸浓度 | 反应时间/min | 收集的气体/mL | 反应速率mL•min-1 |
| ① | 1mol•L-1 | 11 | 10 | |
| ② | 2mol•L-1 | a | 10 | b |
| ③ | 4mol•L-1 | 10 | 5.0 |
A.12和0.83B.6和1.67C.1和10D.6和3.67.
4.下列各组顺序的排列不正确的是( )
| A. | 原子半径:Na>Mg>Al | B. | 热稳定性:HCl<H2S<PH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H3PO4 | D. | 熔点:NaCl>H2O>CO2 |
5.下列用电子式表示化合物的形成过程正确的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
 .
.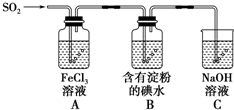 某兴趣小组探究SO2气体还原Fe3+、I2,它们使用的药品和装置如图所示
某兴趣小组探究SO2气体还原Fe3+、I2,它们使用的药品和装置如图所示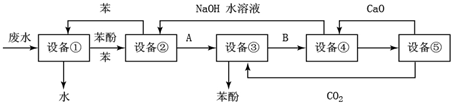 回答下列问题:
回答下列问题: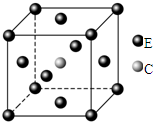 原子序数依次递增且都小于36的A、B、C、D、E五种元素,其中A的一种核素中没有中子,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍.回答下列问题:
原子序数依次递增且都小于36的A、B、C、D、E五种元素,其中A的一种核素中没有中子,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍.回答下列问题: