题目内容
9.某元素二价阳离子的核外有18个电子,质量数为40,则该原子原子核中的中子数为( )| A. | 16 | B. | 18 | C. | 20 | D. | 24 |
分析 阳离子中核内质子数=核外电子数+电荷数,中子数=质量数-质子数,据此分析解答.
解答 解:阳离子中核内质子数=核外电子数+电荷数=18+2=20,中子数=质量数-质子数=40-20=20,
故选C.
点评 本题考查了离子中电子数、质子数、中子数和质量数之间的关系,难度不大,明确阳离子中核内质子数=核外电子数+电荷数,阴离子中核内质子数=核外电子数-电荷数.

练习册系列答案
相关题目
19.氢氧燃料电池已用于航天飞机.以30%KOH溶液为电解质溶液的这种电池在使用时的电极反应如下:2H2+4OH-4e-=4H2O,O2+2H2O+4e-=4OH- 据此作出判断,下列说法中错误的是( )
| A. | 供电时的总反应是:2H2+O2=2H2O | |
| B. | 产物为无污染的水,属于环境友好电池 | |
| C. | 燃料电池的能量转化率无法达到100% | |
| D. | H2在负极发生还原反应 |
17.已知X、Y元素同周期,且第一电离能Y小于X,下列说法一定成立的是( )
| A. | X与Y形成化合物时,X显负价,Y显正价 | |
| B. | 电负性X>Y | |
| C. | 最高价含氧酸的酸性:X对应的酸性弱于Y对应的酸性 | |
| D. | 失去第一个电子消耗能量:X>Y |
4.下列各组顺序的排列不正确的是( )
| A. | 原子半径:Na>Mg>Al | B. | 热稳定性:HCl<H2S<PH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H3PO4 | D. | 熔点:NaCl>H2O>CO2 |
18.将一定量的甲烷在氧气中完全燃烧生成M mol的CO2和N mol的H2O,则M:N为( )
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 3:1 |
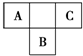 A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.