题目内容
14.工业上用含有少量Cu、Al的废铁屑制备Fe2(SO4)3其反应及操作流程如下:
①加入NaHCO3并搅拌,将混合液pH调控至6.7~7.5范围内,使杂质沉淀过滤除去.
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 | 4.7 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 | 6.7 |
③生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是节约Fe(NO3)3、防止NO污染,气体X与NO配比的比例是3:4.
(3)用Fe2(SO4)3处理含S2-污水时,有黑色沉淀及淡黄色悬浮物产生,其反应的离子方程式是2Fe3++3S2-=2FeS↓+S.
分析 用含有少量Cu、Al的废铁屑制备Fe2(SO4)3,用硫酸溶解后溶液中含有亚铁离子、铜离子和铝离子,加入NaHCO3并搅拌,将混合液pH调控至6.7~7.5,使铜离子和铝离子全部转化为沉淀,而亚铁离子未沉淀,氢离子和硝酸根在同一溶液,相当于稀硝酸,亚铁离子具有还原性,酸性溶液中硝酸根离子具有强氧化性,发生氧化还原反应,生成一氧化氮和三价铁离子,经蒸发结晶、过滤可得到Fe2(SO4)3,以此解答该题.
解答 解:①用硫酸溶解含有少量Cu、Al的废铁屑,溶液中含有亚铁离子、铜离子和铝离子,根据沉淀与PH之间的关系表可知,当PH等于6.7时,铜离子全部转化为氢氧化铜沉淀,铝离子全部转化为氢氧化铝沉淀,此时亚铁离子为沉淀,当PH大于7.5时,亚铁离子开始沉淀,所以PH在6.7~7.5之间,
故答案为:6.7~7.5;
②酸性条件下,硝酸根离子可氧化亚铁离子,该离子反应方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,
故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
③反应Ⅱ中需要强氧化性的酸将二价铁离子氧化,一氧化氮有毒,但一氧化氮易与氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,总的反应为4NO+3O2+2H2O=4HNO3,将O2和反应Ⅱ产生的NO,按3:4配比混合后重新通入反应Ⅱ中,可节约Fe(NO3)3、防止NO污染,
故答案为:节约Fe(NO3)3、防止NO污染;3:4;
(3)根据信息用Fe2(SO4)3处理含S2-污水时,有淡黄色悬浮物产生的是硫,黑色沉淀是硫化亚铁,根据得失电子守恒,硫离子变为单质硫失去2个电子,三价铁离子变为二价铁,得到1个电子,所以三价铁离子和硫化亚铁前的系数都为2,根据原子守恒,该反应的离子反应方程式为2Fe3++3S2-=2FeS↓+S,
故答案为:2Fe3++3S2-=2FeS↓+S.
点评 本题考查物质的制备实验,为高频考点,把握流程中的反应及混合物分离为解答本题的关键,注意酸性条件下硝酸根离子具有强氧化性,侧重分析与实验能力的考查,题目难度中等.

金属Ti(钛)是一种具有许多优良性能的较为昂贵的金属,钛和钛合金被认为是21世纪的重要金属材料。某化学兴趣小组用实验探究Ti、Mg、Cu的活泼性顺序。他们在相同温度下,取大小相同的三种金属薄片,分别投入等体积等浓度的足量稀硫酸中,观察现象如下:
下列有关三种金属的说法正确的是( )
金属 | Ti | Mg | Cu |
金属表面现象 | 放出气泡速度缓慢 | 放出气泡速度快 | 无变化 |
A.在地壳中的含量Mg > Ti,说明金属在地壳中的含量越低,活泼性越弱
B.反应中产生H2速率不同的原因是因为c(H+)不同
C.用Ti从CuSO4溶液中置换出Cu是工业制取Cu的很好途径
D.利用电解装置,Cu可以与稀硫酸反应产生H2
| A. | 异戊二烯与等物质的量的Br2发生反应 | |
| B. | 2-氯丁烷与NaOH乙醇溶液共热发生反应 | |
| C. | 丙烯与H2O在催化剂作用下发生反应 | |
| D. | 新戊烷和氯气生成一氯代物的反应 |
 有机物A与B的分子式为C5H10O2,在酸性条件下均可水解,转化关系如图.下列有关说法中不正确的是( )
有机物A与B的分子式为C5H10O2,在酸性条件下均可水解,转化关系如图.下列有关说法中不正确的是( )| A. | X可以为丁酸,也可以为丙醇 | B. | C分子中的碳原子数最多为3个 | ||
| C. | C可能能发生银镜反应 | D. | X、Y互为同分异构体. |
 ,写出其结构简式: 。
,写出其结构简式: 。
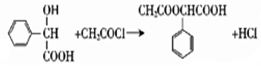
 $→_{H_{2}O}^{HCl}$
$→_{H_{2}O}^{HCl}$
 .
. .
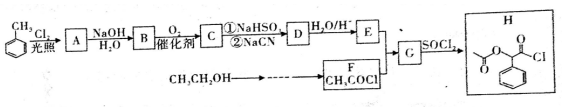
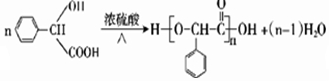
. ;H是另一种副产物,它 是一种高分子化合物,形成这种物质的反应类型为缩聚反应.
;H是另一种副产物,它 是一种高分子化合物,形成这种物质的反应类型为缩聚反应. (填结构简式).
(填结构简式). .
.

 .
. .
.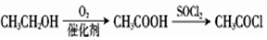 .
.