题目内容
3. 有机物A与B的分子式为C5H10O2,在酸性条件下均可水解,转化关系如图.下列有关说法中不正确的是( )
有机物A与B的分子式为C5H10O2,在酸性条件下均可水解,转化关系如图.下列有关说法中不正确的是( )| A. | X可以为丁酸,也可以为丙醇 | B. | C分子中的碳原子数最多为3个 | ||
| C. | C可能能发生银镜反应 | D. | X、Y互为同分异构体. |
分析 有机物A与B的分子式为C5H10O2,在酸性条件下可水解,则A、B应为酯,都生成C,且分别生成X和Y,则X和Y的分子式相同,结构不同,应为同分异构体.
如C为CH3OH,则X、Y可能分别为CH3CH2CH2COOH或CH3CH(CH3)COOH;
如C为乙醇,则X、Y只能为丙酸,不存在同分异构体;
如C为HCOOH,X、Y为CH3CH2CH2CH2OH、CH3CH2CHOHCH3等;
C还可能为CH3COOH,X、Y分别为CH3CH2CH2OH、CH3CHOHCH3;
如C为丙酸,则X、Y只能为乙醇,不存在同分异构体,以此解答该题.
解答 解:由上述分析可知,C为CH3OH、HCOOH、CH3COOH,符合图中转化,
A.C为甲醇时X为丁酸,C为乙酸时X为丙醇,故A正确;
B.由以上分析可知,C中的碳原子最多为2个,故B错误;
C.如C为HCOOH,含-CHO,可发生银镜反应,故C正确;
D.X和Y的分子式相同,结构不同,X、Y互为同分异构体,故D正确.
故选B.
点评 本题考查有机物的推断,为高频考点,注意根据框图中反应判断C、X、Y的可能组成为解答该题的关键,侧重分析与推断能力的考查,X、Y为同分异构体为解答中易忽略的地方,题目难度中等.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案
相关题目
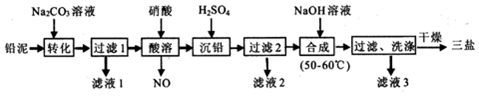
14.工业上用含有少量Cu、Al的废铁屑制备Fe2(SO4)3其反应及操作流程如下:

①加入NaHCO3并搅拌,将混合液pH调控至6.7~7.5范围内,使杂质沉淀过滤除去.
②反应Ⅱ中反应的离子方程式是:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
③生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是节约Fe(NO3)3、防止NO污染,气体X与NO配比的比例是3:4.
(3)用Fe2(SO4)3处理含S2-污水时,有黑色沉淀及淡黄色悬浮物产生,其反应的离子方程式是2Fe3++3S2-=2FeS↓+S.

①加入NaHCO3并搅拌,将混合液pH调控至6.7~7.5范围内,使杂质沉淀过滤除去.
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 | 4.7 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 | 6.7 |
③生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是节约Fe(NO3)3、防止NO污染,气体X与NO配比的比例是3:4.
(3)用Fe2(SO4)3处理含S2-污水时,有黑色沉淀及淡黄色悬浮物产生,其反应的离子方程式是2Fe3++3S2-=2FeS↓+S.
18.利用如图所示装置可制取H2,两个电极均为惰性电极,c为阴离子交换膜,下列叙述正确的是( )


| A. | 左室中NaOH的浓度不变 | |
| B. | 工作时,OH-向左迁移 | |
| C. | 右室电极反应为C2H5OH+5OH--4e-=CH3COO-+4H2O | |
| D. | 右室生成CH3COONa1.5mol,理论上左室生成氢气67.2L |
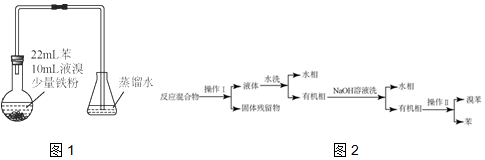
8.实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,CH2=CH2+Br2→BrCH2CH2Br.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:

有关数据列表如下:
回答下列问题:
(1)在装置C中应加入c(选填序号),其目的是吸收反应中可能生成的酸性气体.
①水②浓硫酸③氢氧化钠溶液 ④饱和碳酸氢钠溶液
(2)判断d管中制备二溴乙烷反应已结束的最简单方法是溴的颜色完全褪去.
(3)若产物中有少量未反应的Br2,最好用②(填正确选项前的序号)洗涤除去.
①水②氢氧化钠溶液 ③碘化钠溶液 ④乙醇
(4)反应过程中需用冷水冷却(装置e),其主要目的是避免溴的大量挥发;但不用冰水进行过度冷却,原因是:1,2-二溴乙烷的凝固点较低,过度冷却会使其凝固而使气路堵塞.
(5)以1,2-二溴乙烷为原料,制备聚氯乙烯,为了提高原料利用率,有同学设计了如下流程:1,2-二溴乙烷通过消去反应制得乙炔,反应的化学方程式为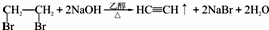 ;乙炔制得氯乙烯;最后由氯乙烯制得氯乙烯,反应的化学方程式为nCH2=CHCl$\stackrel{一定条件}{→}$
;乙炔制得氯乙烯;最后由氯乙烯制得氯乙烯,反应的化学方程式为nCH2=CHCl$\stackrel{一定条件}{→}$ .
.

有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在装置C中应加入c(选填序号),其目的是吸收反应中可能生成的酸性气体.
①水②浓硫酸③氢氧化钠溶液 ④饱和碳酸氢钠溶液
(2)判断d管中制备二溴乙烷反应已结束的最简单方法是溴的颜色完全褪去.
(3)若产物中有少量未反应的Br2,最好用②(填正确选项前的序号)洗涤除去.
①水②氢氧化钠溶液 ③碘化钠溶液 ④乙醇
(4)反应过程中需用冷水冷却(装置e),其主要目的是避免溴的大量挥发;但不用冰水进行过度冷却,原因是:1,2-二溴乙烷的凝固点较低,过度冷却会使其凝固而使气路堵塞.
(5)以1,2-二溴乙烷为原料,制备聚氯乙烯,为了提高原料利用率,有同学设计了如下流程:1,2-二溴乙烷通过消去反应制得乙炔,反应的化学方程式为
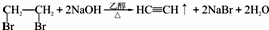 ;乙炔制得氯乙烯;最后由氯乙烯制得氯乙烯,反应的化学方程式为nCH2=CHCl$\stackrel{一定条件}{→}$
;乙炔制得氯乙烯;最后由氯乙烯制得氯乙烯,反应的化学方程式为nCH2=CHCl$\stackrel{一定条件}{→}$ .
.
15.某有机物分子中含有羟基,不考虑羟基与氯原子连在同一个碳原子上的情况,分子式为 C4H9ClO的有机物的同分异构体共有( )
| A. | 8种 | B. | 9种 | C. | 10种 | D. | 12种 |
12. 室温下,用0.100mol•L-1的NaOH溶液分别滴定均为20.00mL0.100mol•L-1的HCl溶液和醋酸溶液,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.100mol•L-1的NaOH溶液分别滴定均为20.00mL0.100mol•L-1的HCl溶液和醋酸溶液,滴定曲线如图所示.下列说法正确的是( )
 室温下,用0.100mol•L-1的NaOH溶液分别滴定均为20.00mL0.100mol•L-1的HCl溶液和醋酸溶液,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.100mol•L-1的NaOH溶液分别滴定均为20.00mL0.100mol•L-1的HCl溶液和醋酸溶液,滴定曲线如图所示.下列说法正确的是( )| A. | I表示的是滴定醋酸的曲线 | |
| B. | pH=7时,滴定醋酸消耗的V(NaOH)>20.00mL | |
| C. | V(NaOH)=20.00mL时,两份溶液中c(Cl-)>c(CH3COO-) | |
| D. | V(NaOH)=10.00mL时,醋酸中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
 .
.