题目内容
9.肉桂酸乙酯是一种天然香料,一般是从红莓、葡萄等植物中提取,但产量过低,工业上合成路线如下:请回答下列问题:
A$→_{①}^{H_{2}O/△}$B$→_{②}^{Ag/△}$C$→_{③}^{HCN}$D$→_{④}^{HCl/H_{2}O}$E$→_{⑤}^{浓H_{2}SO_{4}}$ F$→_{⑥}^{乙醇、浓H_{2}SO_{4}/△}$肉桂酸乙醇
已知:
(ⅰ)A为芳香烃,分子式为C8H8;
(ⅱ)B分子结构中无甲基;
(ⅲ)R-CHO$\stackrel{HCN}{→}$
 $→_{H_{2}O}^{HCl}$
$→_{H_{2}O}^{HCl}$
(1)A所含的官能团名称为碳碳双键,肉酸乙酯的结构简式
 .
.(2)在反应①-⑥中属于加成反应的是①③.
(3)写出反应②的化学方程式
 .
.(4)反应E→F的过程中,存在副产物,G是副产物之一,分子中存在三个六元环,则它的结构简式
 ;H是另一种副产物,它 是一种高分子化合物,形成这种物质的反应类型为缩聚反应.
;H是另一种副产物,它 是一种高分子化合物,形成这种物质的反应类型为缩聚反应.(5)C有多种同分异构体,写出符合以下条件的C的同分异构体:
 (填结构简式).
(填结构简式).①遇FeCl3溶液发生显色反应
②有两个侧链的芳香族化合物.
分析 由信息中A为芳香烃,分子式为C8H8,则A为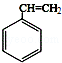 ,结合图中转化关系可知,A与水发生加成反应得B为
,结合图中转化关系可知,A与水发生加成反应得B为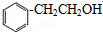 ,B发生氧化反应得C为
,B发生氧化反应得C为 ,C发生成信息中的加成反应得D为
,C发生成信息中的加成反应得D为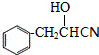 ,D水解得E为
,D水解得E为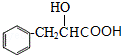 ,E在浓硫酸作用下发生消去反应得F为
,E在浓硫酸作用下发生消去反应得F为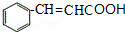 ,F与乙醇发生酯化反应得肉酸乙酯为
,F与乙醇发生酯化反应得肉酸乙酯为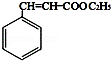 ,以此来解答.
,以此来解答.
解答 解:(1)A为 ,A所含的官能团名称为碳碳双键,肉酸乙酯的结构简式为
,A所含的官能团名称为碳碳双键,肉酸乙酯的结构简式为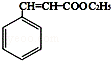 ,
,
故答案为:碳碳双键;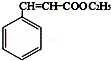 ;
;
(2)根据上面的分析可知,在反应①-⑥中属于加成反应的是①③,
故答案为:①③;
(3)反应②的化学方程式为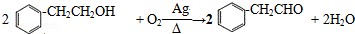 ,
,
故答案为: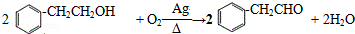 ;
;
(4)反应E→F的过程中,存在副产物,G是副产物之一,分子中存在三个六元环的结构简式为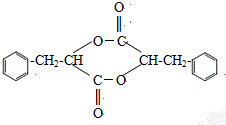 ,H是另一种副产物,它 是一种高分子化合物,形成这种物质的反应类型为缩聚反应,
,H是另一种副产物,它 是一种高分子化合物,形成这种物质的反应类型为缩聚反应,
故答案为: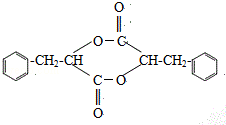 ;缩聚反应;
;缩聚反应;
(5)C的同分异构体,符合以下条件①遇FeCl3溶液发生显色反应,说明有酚羟基,②有两个侧链的芳香族化合物,符合条件的C的同分异构体为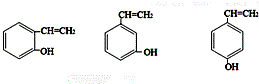 ,
,
故答案为: .
.
点评 本题考查有机物的合成,为高频考点,把握合成流程中碳链变化、官能团变化、有机反应为解答的关键,侧重分析与推断能力的考查,注意信息的应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.工业上用含有少量Cu、Al的废铁屑制备Fe2(SO4)3其反应及操作流程如下:

①加入NaHCO3并搅拌,将混合液pH调控至6.7~7.5范围内,使杂质沉淀过滤除去.
②反应Ⅱ中反应的离子方程式是:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
③生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是节约Fe(NO3)3、防止NO污染,气体X与NO配比的比例是3:4.
(3)用Fe2(SO4)3处理含S2-污水时,有黑色沉淀及淡黄色悬浮物产生,其反应的离子方程式是2Fe3++3S2-=2FeS↓+S.

①加入NaHCO3并搅拌,将混合液pH调控至6.7~7.5范围内,使杂质沉淀过滤除去.
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 | 4.7 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 | 6.7 |
③生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是节约Fe(NO3)3、防止NO污染,气体X与NO配比的比例是3:4.
(3)用Fe2(SO4)3处理含S2-污水时,有黑色沉淀及淡黄色悬浮物产生,其反应的离子方程式是2Fe3++3S2-=2FeS↓+S.
1.过氧化氢对环境友好,性质多样,有很重要的研究和应用价值.
(1)实验室利用反应2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑可制备氧气.
①取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示.
实验1、2研究的是温度对H2O2分解速率的影响.
实验2、3的目的是比较FeCl3溶液和MnO2作为催化剂对H2O2分解反应速率影响的差异.
实验中可以表明该反应速率差异的现象是产生气泡的快慢.
②实验室用MnO2做该反应的催化剂,使用如图所示装置的A部分制备O2,避免反应过于剧烈的操作是旋转分液漏斗的活塞,控制滴加H2O2溶液的速率.

(2)利用图(a)和(b)中的信息,按图(c)装置(连能的A、B瓶中已充有NO2气体)进行实验.可观察到B瓶中气体颜色比A瓶中的深(填“深”或“浅”),其原因是H2O2分解放热,使平衡2NO2═N2O4向生成NO2方向移动

(1)实验室利用反应2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑可制备氧气.
①取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示.
| 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | FeCl3溶液 | ||
| 2 | 20 | FeCl3溶液 | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | 无 | ||
实验2、3的目的是比较FeCl3溶液和MnO2作为催化剂对H2O2分解反应速率影响的差异.
实验中可以表明该反应速率差异的现象是产生气泡的快慢.
②实验室用MnO2做该反应的催化剂,使用如图所示装置的A部分制备O2,避免反应过于剧烈的操作是旋转分液漏斗的活塞,控制滴加H2O2溶液的速率.

(2)利用图(a)和(b)中的信息,按图(c)装置(连能的A、B瓶中已充有NO2气体)进行实验.可观察到B瓶中气体颜色比A瓶中的深(填“深”或“浅”),其原因是H2O2分解放热,使平衡2NO2═N2O4向生成NO2方向移动

18.利用如图所示装置可制取H2,两个电极均为惰性电极,c为阴离子交换膜,下列叙述正确的是( )


| A. | 左室中NaOH的浓度不变 | |
| B. | 工作时,OH-向左迁移 | |
| C. | 右室电极反应为C2H5OH+5OH--4e-=CH3COO-+4H2O | |
| D. | 右室生成CH3COONa1.5mol,理论上左室生成氢气67.2L |
19.分子式为C8H11N的有机物,分子内含有苯环和氨基(-NH2)的同分异构体共数目为( )
| A. | 12 | B. | 13 | C. | 14 | D. | 15 |
 N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,相关图象如下列选项,其中对应分析结论正确的是( )
N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,相关图象如下列选项,其中对应分析结论正确的是( )