题目内容
9.已知:2Fe203(s)+3C(s)═3C02(g)+4Fe(s)△H=+468.2kJ.mol-l;C(s)+02 (g)═C02 (g)△H=-393.5kJ.mol-1;
则4Fe(s)+3O2(g)═2Fe203(s)的△H是( )
| A. | -1648.7 kJ.mo1-1 | B. | -1255.3 kJ.mol-1 | ||
| C. | -861.7 kJ.mol-l | D. | +867.1 kJ.mol-1 |
分析 根据盖斯定律,将热化学方程式②×3-①可得目标热化学方程式:4Fe(s)+3O2(g)═2Fe203(s),据此计算出该热化学方程式的焓变.
解答 解:已知:①2Fe203(s)+3C(s)═3C02(g)+4Fe(s)△H=+468.2kJ•mol-1,
②C(s)+02 (g)═C02 (g)△H=-393.5 kJ•mol-1,
根据盖斯定律②×3-①可得:4Fe(s)+3O2(g)═2Fe203(s)△H=(-393.5kJ•mol-1)×3-(+468.2kJ•mol-1)=-1648.7 kJ•mol-1,
故选A.
点评 本题考查了用盖斯定律进行有关反应热的计算,题目难度中等,明确盖斯定律的含义为解答关键,注意掌握有关反应热计算的方法,试题培养了学生的化学计算能力.

练习册系列答案
 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
5.下列有关实验操作的说法正确的是( )
| A. | 利用澄清石灰水可以鉴别Na2CO3和NaHCO3 | |
| B. | 利用激光笔可以检验豆浆是否属于胶体 | |
| C. | 实验室可以用石英坩埚加热固体NaOH | |
| D. | 用托盘天平称取5.85g NaCl到100mL容量瓶,再用适量蒸馏水溶解定容可配制1.0mol/L NaCl溶液 |
6.常温下,浓度均为0.1mol/L的四种溶液pH如下表,下列说法中正确的是( )
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 8.3 | 10.7 | 4.0 |
| A. | 0.1 mol/L Na2CO3溶液加水,稀释后溶液中所有离子的浓度均减少 | |
| B. | NaHCO3溶液中2c(H2CO3)+c(H+)=c(OH-)+c(CO32-) | |
| C. | NaHSO3溶液中c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-)>c(H+)>c(OH-) | |
| D. | 向NaClO溶液中滴加硫酸至中性时,2c(SO42-)=c(HClO) |
14.下列反应的离子方程式书写正确的是( )
| A. | 用小苏打治疗胃酸过多2H++CO32-═CO2↑+H2O | |
| B. | 用氢氧化钠溶液除去铝表面的氧化膜 Al2O3+2OH-═2AlO2-+H2O | |
| C. | 氯化亚铁溶液通入氯气 Fe2++Cl2═Fe3++2Cl- | |
| D. | 用食醋除去水瓶中的水垢 CO32-+2H+═H2O+CO2↑ |
 (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.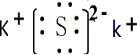 ,属于离子晶体.
,属于离子晶体.