题目内容
17.同学甲查阅资料得知常温下0.1mol•L-1Na2CO3中,发生水解的CO32-不超过其总量的10%.请设计实验加以证明(写出实验方案及预期观察到的现象)答:用pH试纸(或pH计)测常温下0.1mol•L-1 Na2CO3溶液的pH,若pH<12就可 以说明Na2CO3溶液中水解的CO32-不超过其总量的10%.分析 碳酸钠属于强碱弱酸盐,碳酸根离子水解而使溶液呈碱性,根据其水解程度确定溶液pH,用pH试纸测量其pH即可.
解答 解:常温下,0.1mol•L-1的纯碱溶液,发生水解的CO32-离子不超过其总量的10%,则溶液中c(OH-)>0.1mol/L×10%=0.01mol/L,则c(H+)<$\frac{1{0}^{-14}}{0.01}$mol/L=10-12mol/L,所以溶液的pH<12,故操作方法为:用pH试纸测量常温下0.1mol/L碳酸钠溶液的pH,如果溶液的pH<12,则证明发生水解的CO32-离子不超过其总量的10%,
故答案为:用pH试纸(或pH计)测常温下0.1mol•L-1 Na2CO3溶液的pH,若pH<12就可 以说明Na2CO3溶液中水解的CO32-不超过其总量的10%.
点评 考查溶液pH的计算,充分考查学生灵活应用基础知识的能力,注意掌握酸碱混合的定性及溶液pH的计算方法判断方法,明确离子浓度定性比较的常用方法.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案
相关题目
13.对标准状况下的四种气体的关系从小到大表示不正确的是( )
①6.72L甲烷 ②3.01×1023HCl分子 ③13.6g H2S ④0.2mol NH3.
①6.72L甲烷 ②3.01×1023HCl分子 ③13.6g H2S ④0.2mol NH3.
| A. | 质量:④<①<③<② | B. | 密度:①<④<③<② | ||
| C. | 体积:④<①<②<③ | D. | 氢原子数:②<④<③<① |
14. 下列有关如图所示装置的叙述中错误的是( )
下列有关如图所示装置的叙述中错误的是( )
①这是电解NaOH溶液的装置
②Pt为正极,其电极反应为:O2+2H2O+4e-═4OH-
③Fe为阳极,其电极反应为:Fe+2OH--2e-═2Fe(OH)2
④这是一个化学能转化为电能的装置.
 下列有关如图所示装置的叙述中错误的是( )
下列有关如图所示装置的叙述中错误的是( )①这是电解NaOH溶液的装置
②Pt为正极,其电极反应为:O2+2H2O+4e-═4OH-
③Fe为阳极,其电极反应为:Fe+2OH--2e-═2Fe(OH)2
④这是一个化学能转化为电能的装置.
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
5.某溶液仅含Fe2+、Na+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子均为1mol,若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解).下列说法不正确的是( )
| A. | 滴加足量的NaOH溶液后,过滤洗涤灼烧,最终固体为72g | |
| B. | 加入过量稀硫酸,产生的气体遇空气能变成红棕色 | |
| C. | 加人过量的稀硫酸和KSCN溶液,溶液显血红色 | |
| D. | 该溶液中所含的离子是:Fe2+、Na+、SO42-、NO3- |
2.下列实验可达到实验目的是( )
①将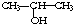 与NaOH的醇溶液共热制备CH3-CH═CH2
与NaOH的醇溶液共热制备CH3-CH═CH2
②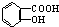 与适量NaHCO3溶液反应制备
与适量NaHCO3溶液反应制备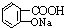
③用浓溴水除去苯中混有的苯酚
④用溴水即可检验CH2=CH-CHO中的碳碳双键.
①将
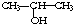 与NaOH的醇溶液共热制备CH3-CH═CH2
与NaOH的醇溶液共热制备CH3-CH═CH2②
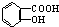 与适量NaHCO3溶液反应制备
与适量NaHCO3溶液反应制备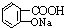
③用浓溴水除去苯中混有的苯酚
④用溴水即可检验CH2=CH-CHO中的碳碳双键.
| A. | 只有①③④ | B. | 只有①④ | C. | 只有① | D. | 都不能 |
9.已知:2Fe203(s)+3C(s)═3C02(g)+4Fe(s)△H=+468.2kJ.mol-l;
C(s)+02 (g)═C02 (g)△H=-393.5kJ.mol-1;
则4Fe(s)+3O2(g)═2Fe203(s)的△H是( )
C(s)+02 (g)═C02 (g)△H=-393.5kJ.mol-1;
则4Fe(s)+3O2(g)═2Fe203(s)的△H是( )
| A. | -1648.7 kJ.mo1-1 | B. | -1255.3 kJ.mol-1 | ||
| C. | -861.7 kJ.mol-l | D. | +867.1 kJ.mol-1 |
6.下列过程中发生化学变化的是( )
| A. | 海水晒盐 | B. | 干冰制冷 | C. | 铁矿石炼铁 | D. | 风能发电 |
7.现有1L 0.5mol/L的硫酸钠溶液,有关溶液的叙述正确的是( )
| A. | 取0.5L溶液,Na+的浓度是0.5mol/L | |
| B. | 取0.1L溶液稀释至l L,SO42-离子浓度是0.05 mol/L | |
| C. | 溶质的离子总数是6.02×1023个 | |
| D. | 该溶液是把0.5molNa2SO4溶于1L水中配制而成的 |