题目内容
8.向盛有 0.1mol/LAgNO3 溶液的试管中滴加 0.05mol/LNa2S 溶液至沉淀完全,再向上层清液中滴加足量 NaCl,产生的现象及发生的反应是( )| A. | 黑色沉淀完全转化为白色沉淀 | B. | 既有 Ag2S 也有 AgCl | ||
| C. | 不能由黑色沉淀转变为白色沉淀 | D. | 只有 AgCl 白色沉淀 |
分析 硫化银的溶度积远小于氯化银的溶度积,所以氯化银饱和溶液中加硫离子会生成硫化银黑色沉淀,但是硫化银饱和溶液中加入氯离子不能生成氯化银沉淀,以此解答该题.
解答 解:硫化银的溶度积远小于氯化银的溶度积,氯化银饱和溶液中加硫离子会生成硫化银黑色沉淀,但由于硫化银饱和溶液中银离子浓度非常小,加入氯离子不能达到生成氯化银沉淀的条件,所以向盛有0.1mol/LAgNO3溶液的试管中滴加0.05mol/LNa2S 溶液至沉淀完全,取上层澄清溶液,逐滴加足量的NaCl溶液,不会生成氯化银白色沉淀,
故选C.
点评 本题考查了沉淀的转化,为高频考点,侧重考查学生的分析能力,把握溶度积小的沉淀能转化为溶度积大的沉淀为解答的关键,题目比较简单.

练习册系列答案
相关题目
5.对于溶液中的反应,不影响反应速率的因素是( )
| A. | 温度 | B. | 压强 | C. | 浓度 | D. | 催化剂 |
6.向 500mLFeCl3溶液中通入一定量的 H2S气体,恰好完全反应,所得滤液的质量比原来增重1g,则原 FeCl3溶液的物质的量浓度为( )
| A. | 1 mol•L-1 | B. | 1.5 mol•L-1 | C. | 2 mol•L-1 | D. | 2.5 mol•L-1 |
3.已知25℃时,Ka(HF)=3.6×10-4mol•L-1,Ksp(CaF2)=1.46×10-10mol3•L-3.现向1L0.2mol•L-1HF溶液中加入1L0.2mol•L-1CaCl2溶液,则下列说法中,正确的是( )
| A. | 25℃时,0.1mol•L-1HF 溶液中pH=1 | |
| B. | Ksp(CaF2)随温度和浓度的变化而变化 | |
| C. | 加入CaCl2溶液后体系中的c(H+)不变 | |
| D. | 该体系中HF与CaCl2反应产生沉淀 |
20.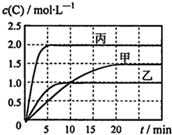 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+хB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中物质C的浓度随时间变化关系分别用表和图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+хB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中物质C的浓度随时间变化关系分别用表和图表示:
下列说法正确的是( )
 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+хB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中物质C的浓度随时间变化关系分别用表和图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+хB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中物质C的浓度随时间变化关系分别用表和图表示:| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T3 |
| 反应物起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |
| A. | 达平衡时A(g)的浓度:乙=丙>甲 | |
| B. | 甲容器中达平衡时B(g)的转化率为75% | |
| C. | 温度分别为T1、T2时,该反应的平衡常数:K(T1)<K(T2) | |
| D. | 丙容器中达到平衡后,若同时向容器中再充入1mol A(g)、1mol B(g)、1molC(g),则平衡向逆反应方向移动 |
18. 已知:2CrO42-+2H+?Cr2O72-+H2O.25℃时,调节初始浓度为1.0mol•L-1 的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线.下列说法不正确的是( )
已知:2CrO42-+2H+?Cr2O72-+H2O.25℃时,调节初始浓度为1.0mol•L-1 的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线.下列说法不正确的是( )
 已知:2CrO42-+2H+?Cr2O72-+H2O.25℃时,调节初始浓度为1.0mol•L-1 的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线.下列说法不正确的是( )
已知:2CrO42-+2H+?Cr2O72-+H2O.25℃时,调节初始浓度为1.0mol•L-1 的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线.下列说法不正确的是( )| A. | 平衡时,pH越小,c(Cr2O72-)越大 | |
| B. | A点CrO42-的平衡转化率为50% | |
| C. | A点CrO42-转化为Cr2O72-反应的平衡常数K=1014 | |
| D. | 平衡时,若溶液中c(Cr2O72-)=c(Cr2O42-),则c(H+)>2.0×10-7 mol•L-1 |
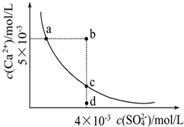 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图.下列叙述正确的是
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图.下列叙述正确的是