题目内容
14.丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活.已知:①2C3H8(g)+7O2(g)=6CO(g)+8H2O(l);△H=-2741.8kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
(1)反应C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)的△H=-2219.9KJ/mol
(2)C3H8在不足量的氧气里燃烧,生成CO和CO2以及气态水,将所有的产物通入一个固定体积的密闭容器中,在一定条件下发生如下可逆反应:CO (g)+H2O(g)?CO2(g)+H2 (g)
①下列事实能说明该反应达到平衡的是bd.
a.体系中的压强不发生变化 b.υ正(H2)=υ逆(CO)
c.混合气体的平均相对分子质量不发生变化 d.CO2的浓度不再发生变化
②T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如表:
| 时间/min | CO | H2O(g) | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | C1 |
| 6 | 0.096 | 0.266 | 0.104 | C2 |
已知420℃时,该化学反应的平衡常数为9.如果反应开始时,CO和H2O(g)的浓度都是0.01mol/L,则CO在此条件下的转化率为75%.又知397℃时该反应的平衡常数为12,请判断该反应的△H<0 (填“>”、“=”、“<”).
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2-.在电池内部O2-移向负极(填“正”或“负”);电池的负极反应式为C3H8+10O2--20e-=3CO2+4H2O.
(4)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液.电解开始后阴极的现象为有无色气体生成,有白色沉淀生成.
分析 (1)根据盖斯定律来计算丙烷完全燃烧的反应热,由①2C3H8(g)+7O2 (g)=6CO (g)+8H2O△H1=-2741.8kJ/mol,
②2CO (g)+O2(g)=2CO2 (g)△H2=-566kJ/mol,根据盖斯定律可知,$\frac{①+②×3}{2}$可得;
(2)①反应为气体体积不变的反应,利用平衡的特征“等”、“定”及由此衍生的一些量来分析;
②第4~5min之间,反应物的浓度增大,二氧化碳的浓度减小,平衡向正反应方向移动;第5~6min之间,生成物的浓度增大,且水的浓度增大,则改变条件是增大水的量;化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比;根据化学平衡常数计算生成物的浓度,转化率等于反应的浓度与初始浓度的比;420℃时,该化学反应的平衡常数为9,又知397℃时该反应的平衡常数为12,升高温度平衡常数减小,则平衡逆向移动,正反应为放热反应;
(3)原电池内部阴离子向由正极向负极移动;原电池负极放出氧化反应,丙烷在负极放电,与O2-结合生成二氧化碳与水;
(4)电解池阴极发生还原反应,阳离子在阴极放电,H+(实际是水)在阴极放电生成氢气,产生氢氧根离子,氢氧根离子与镁离子反应生成氢氧化镁沉淀.
解答 解:(1)由①2C3H8(g)+7O2 (g)=6CO (g)+8H2O△H1=-2741.8kJ/mol,
②2CO (g)+O2(g)=2CO2 (g)△H2=-566kJ/mol,
根据盖斯定律可知,$\frac{①+②×3}{2}$可得C3H8(g)+5O2 (g)=3CO2 (g)+4H2O,
其反应热为$\frac{(-2741.8KJ/mol)+(-566KJ/mol)×3}{2}$=-2219.9KJ/mol,
故答案为:-2219.9KJ/mol;
(2)①a.由反应可知,反应前后的压强始终不变,则体系中的压强不发生变化,不能判断平衡,故a错误;
b.v正(H2)=v逆(CO),说明一氧化碳正逆反应速率相同,说明反应达到平衡状态,故b正确;
c.,因体积不变,气体的总质量不变,气体体积不变,所以混合气体的平均摩尔质量始终不变,不发生变化,不能判断平衡,故c错误;
d.CO2的浓度不再发生变化,由平衡的特征“定”可知,则化学反应达到平衡,故d正确;
故答案为:bd;
②第4~5min之间,反应物的浓度增大,二氧化碳的浓度减小,平衡向正反应方向移动,则改变条件是增大氢气浓度,第5~6min之间,生成物的浓度增大,且水的浓度增大,则改变条件是增大水浓度,420℃时,设参加反应的CO的浓度为x,则K=$\frac{x×x}{(0.01-x)(0.01-x)}$=9,解之得x=0.0075mol/L,则在此条件下的转化率为$\frac{0.0075mol/L}{0.01mol/L}$×100%=75%,420℃时,该化学反应的平衡常数为9,又知397℃时该反应的平衡常数为12,升高温度平衡常数减小,则平衡逆向移动,正反应为放热反应,则△H<0,
故答案为:增加H2浓度;增加H2O(g)浓度;75%;<;
(3)原电池内部阴离子向由正极向负极移动,所以电池内部O2-由正极移向负极;原电池负极放出氧化反应,丙烷在负极放电,与O2-结合生成二氧化碳与水,电极反应式为C3H8+10O2--20e-=3CO2+4H2O.
故答案为:负;C3H8+10O2--20e-=3CO2+4H2O.
(4)电解池阴极发生还原反应,阳离子在阴极放电,水在阴极放电,电极反应式为2H2O-2e-=H2↑+2OH-,同时反应反应Mg2++2OH-=Mg(OH)2↓,故电解开始后阴极的现象为:有无色气体生成,有白色沉淀生成.
故答案为:有无色气体生成,有白色沉淀生成.
点评 本题考查盖斯定律、反应热的计算、化学反应速率、原电池、影响化学平衡的因素、平衡常数的有关计算,题目难度中等.

 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案现在隔一定时间对该容器内的物质进行分析,得到如下表格:
| t/s c/(mol•L-1) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/(mol•L-1) | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2)/(mol•L-1) | 0 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
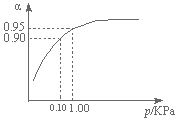
(1)达到平衡时N2O4的转化率为60%,表中c2>c3,a=b(后两空选填>、<、=)
(2)20s的N2O4的浓度c1=0.07mol/L在0~20s内N2O4的平均反应速率为0.0015mol/(L•s);
(3)若其他反应条件以及初始物质物质的量不变,将反应的温度降低到80℃时,达到平衡时NO2的物质的量为0.100mol,那么正反应是吸热反应(选填吸热或放热)
(4)若在相同初始情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度为0.20mol/L.
| A. | SiO2熔点高,可用作光导纤维 | |
| B. | Li还原性强且质轻,常用作负极材料 | |
| C. | Fe2(SO4)3具有氧化性,能用作净水剂 | |
| D. | SO2能杀菌,可用于漂白纸浆 |
| A. | 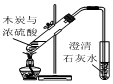 用如图所示装置验证反应产物二氧化碳 | |
| B. | 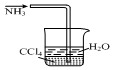 用如图装置吸收氨气并防止倒吸 | |
| C. |  如图装置配制100 mL 1 mol•L-1的硫酸 | |
| D. | 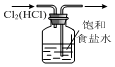 用如图装置除去氯气中的氯化氢 |
| A. | 100℃时,某溶液pH=6,则该溶液一定显酸性 | |
| B. | 25℃时,0.1mol/L的NaHSO3溶液pH=4,溶液中c(SO32-)<c(H2SO3) | |
| C. | 25℃时,pH=3的硫酸溶液与pH=11的氨水等体积混合,所得溶液呈酸性 | |
| D. | 室温下,10mL0.1mol/L CH3COOH溶液与5mLO.lmol/LNaOH溶液混合,所得溶液中有:2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-) |
| A. | 生成1 mol NaNO3需消耗0.4 mol KMnO4 | |
| B. | 反应过程中溶液的pH减小 | |
| C. | 该反应中NO${\;}_{2}^{-}$被还原 | |
| D. | X可以是盐酸 |

 ,分子较小的单体含氧官能团名称是羟基.
,分子较小的单体含氧官能团名称是羟基. .
. )的原料.
)的原料. )反应生成阿司匹林的化学方程式:
)反应生成阿司匹林的化学方程式: .
. ,该同分异构体符合以下条件:
,该同分异构体符合以下条件: