题目内容
3.化学在生产、生活中有广泛应用,下列对应关系不正确的是( )| 选项 | 性质 | 实际应用 |
| A | MgO熔点高 | 可用作耐火材料 |
| B | KMnO4具有强氧化性 | 可用于漂白织物 |
| C | 常温下,铁能被浓硫酸钝化 | 常温下,可用铁质器皿盛放浓硫酸 |
| D | TiCl4在水中能发生水解 | 可用TiCl4溶液制备TiO2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.耐火材料应具由较高的熔点;
B.高锰酸钾不具有漂白性;
C.依据浓硫酸的强氧化性解答;
D.TiCl4溶液水解生成H2TiO3,钛酸加热分解生成二氧化钛.
解答 解:A.氧化镁具有较高的熔点,可以用作耐火材料,故A正确;
B.高锰酸钾不具有漂白性,不能漂白织物,故B错误;
C.浓硫酸具有强氧化性,常温下能够使铁钝化,所以可以可用铁质器皿盛放浓硫酸,故C正确;
D.TiCl4溶液水解生成H2TiO3,钛酸加热分解生成二氧化钛,故D正确;
故选:B.
点评 本题考查了元素化合物知识,侧重考查元素化合物的用途,明确相关物质的性质是解题关键,注意盐类水解的应用,题目难度不大.

练习册系列答案
相关题目
14. 【化学-选修2化学与技术】
【化学-选修2化学与技术】
许多含碳、氢物质是重要的化工原料.
(1)某新型储氢合金(化学式为Mg17Al12)的储氢原理为Mg17Al12+17H2═17MgH2+12Al,此变化中还原产物是MgH2(填化学式).
(2)草酸的钙盐、钡盐、镁盐难溶于水.已知C2O3是无色无味气体,可溶于水生成草酸(H2C2O4),写出它溶于足量Ba(OH)2溶液发生反应的化学方程式C2O3+Ba(OH)2=BaC2O4↓+H2O.
(3)已知:几个热化学方程式如下:
①H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-198kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2
③CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H3=-846.3kJ•mol-1
写出甲烷与水蒸气在高温下制备合成气(CO,H2)的热化学方程式CH4(g)+H2O(g)?CO(g)+3H2(g)△H=30.7KJ/mol.
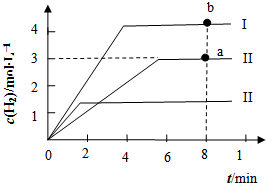
(4)向2L恒容密闭容器中充入3mol CH4(g)、4mol H2O(g),发生反应制备CO、H2,测得温度为t℃时,容器内H2的物质的量浓度(mol•L-1)随时间的变化如图中II曲线所示.图中I、III分别表示相对于II仅改变反应条件后,c(H2)随时间的变化.
①若曲线I仅代表改变一种条件后的情况,则改变的条件可能是升温;a、b两点用CO浓度变化表示的净反应速率关系为a<b;
②曲线II对应反应的平衡常数K为54.该温度下,若将等物质的量浓度的CH4(g)、H2O(g)、CO(g)、H2(g)混合充入该容器中,则开始进行方向是无法确定(填:向左、向右、平衡或无法确定).
③曲线III相对于曲线II改变的条件是B.
A.降低温度 B.使用催化剂、降低温度 C.加压.
 【化学-选修2化学与技术】
【化学-选修2化学与技术】许多含碳、氢物质是重要的化工原料.
(1)某新型储氢合金(化学式为Mg17Al12)的储氢原理为Mg17Al12+17H2═17MgH2+12Al,此变化中还原产物是MgH2(填化学式).
(2)草酸的钙盐、钡盐、镁盐难溶于水.已知C2O3是无色无味气体,可溶于水生成草酸(H2C2O4),写出它溶于足量Ba(OH)2溶液发生反应的化学方程式C2O3+Ba(OH)2=BaC2O4↓+H2O.
(3)已知:几个热化学方程式如下:
①H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-198kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2
③CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H3=-846.3kJ•mol-1
| 化学键 | C≡O | O═O | C═O(CO2中) |
| 键能(kJ•mol-1) | 958.5 | 497 | 745 |
(4)向2L恒容密闭容器中充入3mol CH4(g)、4mol H2O(g),发生反应制备CO、H2,测得温度为t℃时,容器内H2的物质的量浓度(mol•L-1)随时间的变化如图中II曲线所示.图中I、III分别表示相对于II仅改变反应条件后,c(H2)随时间的变化.
①若曲线I仅代表改变一种条件后的情况,则改变的条件可能是升温;a、b两点用CO浓度变化表示的净反应速率关系为a<b;
②曲线II对应反应的平衡常数K为54.该温度下,若将等物质的量浓度的CH4(g)、H2O(g)、CO(g)、H2(g)混合充入该容器中,则开始进行方向是无法确定(填:向左、向右、平衡或无法确定).
③曲线III相对于曲线II改变的条件是B.
A.降低温度 B.使用催化剂、降低温度 C.加压.
11.已知在常温常压下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
| A. | 2H2 (g)+O2(g)=2H2O(l);△H=-484kJ•mol-1 | |
| B. | 2H2 (g)+O2(g)=2H2O(g);△H=+484kJ•mol-1 | |
| C. | H2 (g)+$\frac{1}{2}$O2(g)=H2O(g);△H=+242kJ•mol-1 | |
| D. | H2O(g)=H2(g)+$\frac{1}{2}$O2(g);△H=+242kJ•mol-1 |
8.下列实验操作能达到实验目的是( )
| A. | 向容量瓶中注入液体时,奖容量瓶的玻璃塞倒置在桌面上防止被污染 | |
| B. | 鉴别NO2和溴蒸汽时,将二者分别通到湿润的KI-淀粉试纸上观察颜色变化 | |
| C. | 将甲烷和乙烯的混合气体通入足量溴水,以除去乙烯 | |
| D. | 将洗净的滴定管放到烘箱中烘干,以加快干燥速度 |
13.锌一空气燃料电池可作电动车动力电源,电解质溶液为KOH,反应为2Zn+O2+2H2O+4OH-=2Zn(OH)42-.下列说法正确的是( )
| A. | 放电时,电解质溶液中K+移向负极 | |
| B. | 放电时,电解质溶液的pH 不变 | |
| C. | 充电时,阴极的反应为:Zn(OH)42-+2e-=Zn+4OH- | |
| D. | 充电时,当有4.48L 氧气(标准状况下)释放出来时,则析出固体Zn为13g |

 ,分子较小的单体含氧官能团名称是羟基.
,分子较小的单体含氧官能团名称是羟基. .
. )的原料.
)的原料. )反应生成阿司匹林的化学方程式:
)反应生成阿司匹林的化学方程式: .
. ,该同分异构体符合以下条件:
,该同分异构体符合以下条件: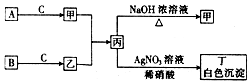 已知A、B、C为中学常见的气体单质,甲、乙、丙、丁为常见的化合物,甲的水溶液呈碱性.它们之间有如图所示的转化关系(部分产物及反应条件已略去)
已知A、B、C为中学常见的气体单质,甲、乙、丙、丁为常见的化合物,甲的水溶液呈碱性.它们之间有如图所示的转化关系(部分产物及反应条件已略去)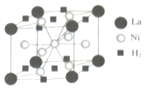 钒和镍及其化合物是重要的催化剂和合金材料.请回答:
钒和镍及其化合物是重要的催化剂和合金材料.请回答: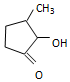 可形成配合物.
可形成配合物. 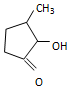 中,三种非金属原子的第一电离能由大到小的顺序为O>C>H(用元素符号表示);C原子的杂化轨道类型为sp3和sp2.
中,三种非金属原子的第一电离能由大到小的顺序为O>C>H(用元素符号表示);C原子的杂化轨道类型为sp3和sp2. 氢能是一种极具发展潜力的清洁能源.硫碘循环分解水是最具潜力的制氢方法.其反应原理如下:
氢能是一种极具发展潜力的清洁能源.硫碘循环分解水是最具潜力的制氢方法.其反应原理如下: