题目内容
16.短周期元素W、X、Y、Z、M的原子序数依次增大,元素W的一种核素的中子数为0,X的原子最外层电子数是次外层的2倍,Z与M同主族,Z2-电子层结构与氖相同.(1)M位于元素周期表中第三周期VIA族.
(2)化合物p由W、X、Y、M四种元素组成.已知向p溶液中加入FeCl3溶液,溶液变血红色;向p溶液中加入NaOH溶液并加热可放出使湿润的红色石蕊试纸变蓝的气体.p的化学式为NH4SCN.
(3)由X、Y、Z三种元素可组成摩尔质量为84g•mol-1的物质q,且q分子中三种元素的原子个数之比为1:1:1.已知q分子中各原子均达到8电子稳定结构,且分子中不含双键,但含极性键和非极性键,q分子的结构式为N≡C-O-O-C≡N.
(4)(XY)2的性质与Cl2相似,(XY)2与NaOH溶液反应的离子方程式为(CN)2+2OH-=CN-+CNO-+H2O.
(5)常温下,1molZ3能与Y的最简单氢化物反应,生成一种常见的盐和1molZ2,该反应的化学方程式为2NH3+2O3=NH4NO3+O2+H2O.
分析 元素W的一种核素的中子数为0,应为H,X的原子最外层电子数是次外层的2倍,应为C元素,Z与M同主族,Z2-电子层结构与氖相同,则Z为O元素,M为S元素,由此可知Y为N元素.
(1)M为S元素,位于周期表第三周期族VIA;
(2)向p溶液中加入FeCl3溶液,溶液变血红色,说明含有SCN-离子,向p溶液中加入NaOH溶液并加热可放出使湿润的红色石蕊试纸变蓝的气体,说明含有铵根离子;
(3)X中三种元素的原子数目之比为1:1:1,设分子式为:(CON)x,则x=$\frac{84}{12+16+14}$=2,所以分子式为:(CON)2,各原子均达到8电子稳定结构,可确定结构式;
(4)(CN)2的性质与Cl2相似,(CN)2与NaOH溶液反应生成CN-、CNO-、H2O;
(5)常温下,1molO3能与N的最简单氢化物反应,生成一种常见的盐和1molN2,盐为硝酸铵.
解答 解:元素W的一种核素的中子数为0,应为H,X的原子最外层电子数是次外层的2倍,应为C元素,Z与M同主族,Z2-电子层结构与氖相同,则Z为O元素,M为S元素,由此可知Y为N元素.
(1)M为S元素,位于周期表第三周期族VIA,故答案为:三;VIA;
(2)向p溶液中加入FeCl3溶液,溶液变血红色,说明含有SCN-离子,向p溶液中加入NaOH溶液并加热可放出使湿润的红色石蕊试纸变蓝的气体,说明含有铵根离子,则应为NH4SCN.故答案为:NH4SCN;
(3)X中三种元素的原子数目之比为1:1:1,设分子式为:(CON)x,则x=$\frac{84}{12+16+14}$=2,所以分子式为:(CON)2,各原子均达到8电子稳定结构,且分子中无双键,所以结构式为:N≡C-O-O-C≡N,
故答案为:N≡C-O-O-C≡N;
(4)(CN)2的性质与Cl2相似,(CN)2与NaOH溶液反应的离子方程式为(CN)2+2OH-=CN-+CNO-+H2O,故答案为:(CN)2+2OH-=CN-+CNO-+H2O;
(5)常温下,1mol O3能与N的最简单氢化物反应,生成一种常见的盐和1molO2,该反应的化学方程式为2NH3+2O3=NH4NO3+O2+H2O,
故答案为:2NH3+2O3=NH4NO3+O2+H2O.
点评 本题考查了元素周期表和元素周期律的综合应用,为高频考点,侧重于学生的分析能力的考查,题目涉及化学反应方程式、元素周期律等知识点,难度不大.

| A. | 一定温度下,某密闭容器发生如下反应:CaCO3(s)?CaO(s)+CO2(g),达到平衡后,将容器体积缩小为原来的一半,当体系再次达到化学平衡时,CO2的物质的量浓度不变 | |
| B. | 已知某温度下,Kw=l×10-13,若将pH=8的NaOH溶液与pH=5的H2SO4溶液混合,保持温度不变,欲使混合溶液pH=7,则NaOH溶液与H2SO4溶液的体积比为11:9 | |
| C. | 已知:KSP(AgCl)=1.8×10-10,Ksp(Ag2CrO2)=2.0×10-12,将0.001 mol•L-1的AgNO3溶液滴入0.001mol•L-1 KCl和0.001 rnol•L-1IK2CrO4的混合溶液中,先产生AgCl沉淀 | |
| D. | 已知25℃时,有关弱酸的电离平衡常数:HCNKa=4.9×10-10:H2CO3,Ka1=4.3×10-7,Ka2=5.6×10-11.则CO2通入NaCN溶液中反应的化学方程式为:2NaCN+H2O+CO2═2HCN+Na2CO3 |
下列说法正确的是( )
| A. | a=2 | |
| B. | x=18 | |
| C. | M的化学式为MgO | |
| D. | 该反应中Mg5Al3(OH)x(H2O)4既是氧化剂又是还原剂 |
| A. | SiO2通常用于通讯行业 | |
| B. | 发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔;而碳酸钠可作医疗上治疗胃酸过多的一种药剂 | |
| C. | 明矾可用作净水剂 | |
| D. | 金属钠可用于冶炼钛等金属 |
| t/℃ | 700 | 800 | 900 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
(2)该反应为吸热反应(选填吸热、放热).
(3)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为900℃
(4)900℃时,在1L固定的密闭容器中,加入2mol CO2和1mol H2,反应进行一段时间后,测得CO的浓度为0.5mol/L,则此时该反应是否达到平衡状态否(填“是”或“否”),此时v(正)大于v(逆)(填“大于”“小于”或“等于”),达到平衡时CO2的转化率为33.3%.
(5)化学平衡移动原理同样也适用于溶液中的平衡,已知在氨水中存在下列平衡:
NH3+H2O?NH3•H2O?NH4++OH-
①向氨水中加入MgCl2固体时,平衡向右移动(填“左”或“右”),溶液中OH-的浓度B(填序号,下同),NH4+离子的浓度A.
A.变大B.变小C.不变
②向浓氨水中加入少量的NaOH固体,上述平衡向左移动(填“左”或“右”),溶液中OH-的浓度A(填序号,下同),NH4+离子的浓度B.
A.变大B.变小C.不变.
 【化学-选修2化学与技术】
【化学-选修2化学与技术】许多含碳、氢物质是重要的化工原料.
(1)某新型储氢合金(化学式为Mg17Al12)的储氢原理为Mg17Al12+17H2═17MgH2+12Al,此变化中还原产物是MgH2(填化学式).
(2)草酸的钙盐、钡盐、镁盐难溶于水.已知C2O3是无色无味气体,可溶于水生成草酸(H2C2O4),写出它溶于足量Ba(OH)2溶液发生反应的化学方程式C2O3+Ba(OH)2=BaC2O4↓+H2O.
(3)已知:几个热化学方程式如下:
①H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-198kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2
③CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H3=-846.3kJ•mol-1
| 化学键 | C≡O | O═O | C═O(CO2中) |
| 键能(kJ•mol-1) | 958.5 | 497 | 745 |
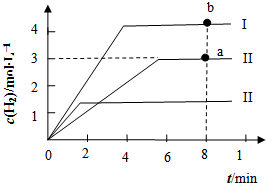
(4)向2L恒容密闭容器中充入3mol CH4(g)、4mol H2O(g),发生反应制备CO、H2,测得温度为t℃时,容器内H2的物质的量浓度(mol•L-1)随时间的变化如图中II曲线所示.图中I、III分别表示相对于II仅改变反应条件后,c(H2)随时间的变化.
①若曲线I仅代表改变一种条件后的情况,则改变的条件可能是升温;a、b两点用CO浓度变化表示的净反应速率关系为a<b;
②曲线II对应反应的平衡常数K为54.该温度下,若将等物质的量浓度的CH4(g)、H2O(g)、CO(g)、H2(g)混合充入该容器中,则开始进行方向是无法确定(填:向左、向右、平衡或无法确定).
③曲线III相对于曲线II改变的条件是B.
A.降低温度 B.使用催化剂、降低温度 C.加压.
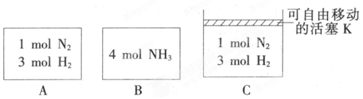

 ,分子较小的单体含氧官能团名称是羟基.
,分子较小的单体含氧官能团名称是羟基. .
. )的原料.
)的原料. )反应生成阿司匹林的化学方程式:
)反应生成阿司匹林的化学方程式: .
. ,该同分异构体符合以下条件:
,该同分异构体符合以下条件: 钒和镍及其化合物是重要的催化剂和合金材料.请回答:
钒和镍及其化合物是重要的催化剂和合金材料.请回答: 可形成配合物.
可形成配合物. 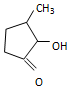 中,三种非金属原子的第一电离能由大到小的顺序为O>C>H(用元素符号表示);C原子的杂化轨道类型为sp3和sp2.
中,三种非金属原子的第一电离能由大到小的顺序为O>C>H(用元素符号表示);C原子的杂化轨道类型为sp3和sp2.