题目内容
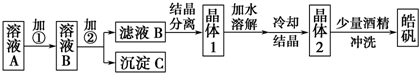
6.SnSO4是一种重要的硫酸盐,在工业生产中有着广泛的应用.其制备路线如下:
已知:在酸性条件下,溶液中的Sn2+可被空气中的氧气氧化成Sn4+; SnCl2能水解生成碱式氯化亚锡[Sn(OH)Cl].
(1)写出物质A的名称:硫酸.
(2)SnCl2用盐酸而不用水溶解的原因是2Sn2++O2+4H+═2Sn4++2H2O(用化学方程式表示).
(3)锡粉的作用是除去酸溶时产生的少量Sn4+,请写出产生Sn4+的离子方程式:2Sn2++O2+4H+═2Sn4++2H2O.
(4)反应Ⅰ生成的沉淀为SnO,写出该反应的化学方程式:SnCl2+2NH4HCO3═SnO↓+2CO2↑+2NH4Cl+H2O;该反应的温度需要控制在75℃左右的原因是温度较低时反应速率小,温度较高时碳酸氢铵会分解.
(5)实验室中“漂洗”沉淀的实验操作方法是(沿玻璃棒)向漏斗(或过滤器)中加蒸馏水至浸没沉淀,(静置)待水全部流出后,重复操作2~3次;如何鉴别是否漂洗干净取最后一次漂洗液1-2mL于试管中,滴加硝酸酸化的AgNO3,若产生白色沉淀则说明没有漂洗干净,反之漂洗干净.
分析 SnCl2先用盐酸溶解,后又加了锡粉主要是防止在溶解时水解和被空气中氧气氧化,在过滤出锡粉,得到SnCl2溶液在反应Ⅰ与碳酸氢铵反应生成SnO、氯化铵、二氧化碳和水,再过滤得到SnO沉淀,经过漂洗除去表面的杂质离子,再在反应Ⅱ中与硫酸反应生成SnSO4,进一步提炼最终得到SnSO4晶体,
(1)根据分析判断物质A的名称;
(2)SnCl2易水解生成碱式氯化亚锡,加入盐酸,抑制Sn2+水解;
(3)酸性条件下,SnCl2可以被空气中的氧气氧化,将Sn2+氧化为Sn4+,自身被还原为水;
(4)反应Ⅰ得到沉淀是SnO,Sn元素化合价没有变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳;碳酸氢铵受热易分解;
(5)(沿玻璃棒)向漏斗(或过滤器)中加蒸馏水至浸没沉淀,(静置)待水全部流出后,重复操作2~3次;通过检测最后一次漂洗液中是否含有氯离子的方法鉴别是否漂洗干净.
解答 解:SnCl2先用盐酸溶解,后又加了锡粉主要是防止在溶解时水解和被空气中氧气氧化,在过滤出锡粉,得到SnCl2溶液在反应Ⅰ与碳酸氢铵反应生成SnO、氯化铵、二氧化碳和水,再过滤得到SnO沉淀,经过漂洗除去表面的杂质离子,再在反应Ⅱ中与硫酸反应生成SnSO4,进一步提炼最终得到SnSO4晶体,
(1)根据分析可知,SnO与物质A反应生成SnSO4,则A为硫酸,
故答案为:硫酸;
(2)SnCl2易水解生成碱式氯化亚锡,存在平衡Sn Cl2+H2O?Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解,
故答案是:SnCl2+H2O?Sn(OH)Cl+HCl;
(3)酸性条件下,SnCl2可以被空气中的氧气氧化,将Sn2+氧化为Sn4+,自身被还原为水,反应离子方程式为:2Sn2++O2+4H+═2Sn4++2H2O,
故答案为:2Sn2++O2+4H+═2Sn4++2H2O;
(4)反应Ⅰ得到沉淀是SnO,Sn元素化合价没有变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳,化学方程式为:SnCl2+2NH4HCO3═SnO↓+2CO2↑+2NH4Cl+H2O,温度较低时反应速率小,温度较高时碳酸氢铵会分解,
故答案为:SnCl2+2NH4HCO3═SnO↓+2CO2↑+2NH4Cl+H2O;温度较低时反应速率小,温度较高时碳酸氢铵会分解;
(5)实验室中“漂洗”沉淀的方法是:(沿玻璃棒)向漏斗(或过滤器)中加蒸馏水至浸没沉淀,(静置)待水全部流出后,重复操作2~3次;
漂洗液中若含有氯离子,则洗涤不干净,所以鉴别是否漂洗干净的操作方法为:取最后一次漂洗液1-2mL于试管中,滴加硝酸酸化的AgNO3,若产生白色沉淀则说明没有漂洗干净,反之漂洗干净,
故答案为:(沿玻璃棒)向漏斗(或过滤器)中加蒸馏水至浸没沉淀,(静置)待水全部流出后,重复操作2~3次;取最后一次漂洗液1-2mL于试管中,滴加硝酸酸化的AgNO3,若产生白色沉淀则说明没有漂洗干净,反之漂洗干净.
点评 本题SnSO4制备的之比为载体,考查学生对工艺流程的理解、物质的分离提纯、阅读题目获取信息的能力、常用化学用语书写及利用关系式进行的计算等,题目难度中等,明确实验原理、实验目的为解答关键,试题培养了学生的化学实验能力.

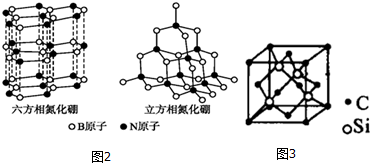
| A. | “西气东输”中的“气”指的是煤气 | |
| B. | 我国使用最早的合金为青铜,主要成分是 Cu 和 Sn | |
| C. | 自然界存在大量游离态的硫及硅 | |
| D. | 氮是动植物生长不可缺少的元素,是油脂的组成元素之一 |
| A. | Ca(OH)2微溶于水,所以Ca(OH)2是弱电解质 | |
| B. | 强电解质溶液的导电能力可能比弱电解质溶液导电能力弱 | |
| C. | Cu、NaCl溶液不是电解质,所以是非电解质 | |
| D. | SO3溶于水后导电,所以SO3是电解质 |
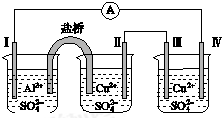
| A. | 电极Ⅰ发生还原反应 | B. | 电流方向:电极Ⅳ→ →电极Ⅰ →电极Ⅰ | ||
| C. | 电极Ⅱ逐渐溶解 | D. | 电极Ⅲ的电极反应:Cu2++2e-═Cu |
| A. | 1:1 | B. | 2:1 | C. | 2:3 | D. | 3:2 |