题目内容
11.物质的结构决定物质的性质.请回答下列涉及物质结构和性质的问题:(1)第2周期中,元素的第一电离能处于B与N之间的元素有3种.
(2)某元素位于第4周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为3d84s2.
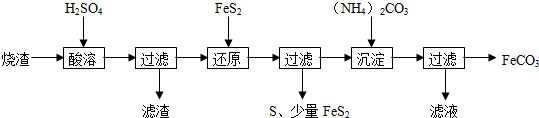
(3)氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如图1),a位置上Cl原子的杂化轨道类型为sp3.已知其中一种化合物的化学式为KCuCl3,另一种的化学式为K2CuCl3.
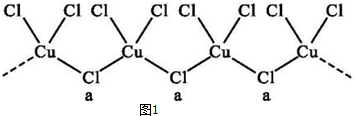
(4)氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图2所示.
①关于这两种晶体的说法,正确的是bc(填序号);
a.立方相氮化硼含有σ键和π键,所以硬度大
b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的B-N键均为共价键
d.两种晶体均为分子晶体
②六方相氮化硼晶体与石墨相似却不导电,其原因是六方相氮化硼晶体的片状结构中没有自由电子.
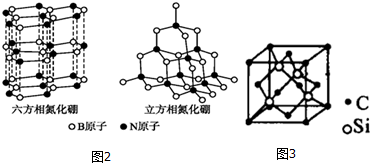
(5)如图3,碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能.碳化硅晶胞结构中每个碳原子周围与其距离最近的硅原子有4个,与碳原子等距离最近的碳原子有12个.已知碳化硅晶胞边长为a pm,碳化硅的密度为$\frac{1.6×1{0}^{32}}{{a}^{3}×{N}_{A}}$g•cm-3.
分析 (1)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于同周期相邻元素的;
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,碳原子的电子排布为1s22s22p2,未成对电子数为2,则该元素为Ni;
(3)a位置上Cl原子成2个单键,含有2对孤对电子,杂化轨道数为4;
一种化合物的化学式为KCuCl3,其中铜元素为+2价,故另一种化合物中铜为+1价,阴离子构成与CuCl3一样,但CuCl3原子团的化合价为-2;
(4)①a.立方相氮化硼中N原子与B原子之间形成单键;
b.六方相氮化硼层间作用力为范德华力;
c.两种晶体中的B-N键均为共价键;
d.立方相氮化硼是超硬材料,有优异的耐磨性,属于原子晶体;
②六方相氮化硼晶体的片状结构中没有自由电子;
(5)根据均摊法计算晶胞中Si、C原子数目,每个Si原子周围有4个碳原子,原子配位数与原子数目成反比,可以计算碳原子周围与其距离最近的硅原子数目;
以顶点C原子研究,与之距离最近的C原子位于面心上,每个顶点原子为8个晶胞共用,每个面为2个晶胞共用;
结合晶胞中原子数目,表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算晶体密度.
解答 解:(1)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,半充满的N原子和全充满的Be原子第一电离能要比同周期相邻元素的高,故第一电离能介于B、N之间的第二周期元素有Be、C、O三种元素,
故答案为:3;
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,C原子的电子排布为1s22s22p2,未成对电子数为2,则该元素为Ni,其基态原子的价层电子排布式为3d84s2,
故答案为:3d84s2;
(3)a位置上Cl原子成2个单键,含有2对孤对电子,杂化轨道数为4,杂化轨道类型为:sp3,
一种化合物的化学式为KCuCl3,其中铜元素为+2价,故另一种化合物中铜为+1价,CuCl3原子团的化合价为-2,其化学式为:K2CuCl3,
故答案为:sp3;K2CuCl3;
(4)①a.立方相氮化硼中N原子与B原子之间形成单键,不含π键,属于原子晶体,所以硬度大,故a错误
b.六方相氮化硼层间作用力为范德华力,所以质地软,故b正确;
c.两种晶体中的B-N键均为共价键,故c正确;
d.立方相氮化硼是超硬材料,有优异的耐磨性,属于原子晶体,故d错误,
故选:bc;
②六方相氮化硼晶体的片状结构中没有自由电子,而石墨晶体片状结构中有自由电子,故石墨可以导电、六方相氮化硼不导电,
故答案为:六方相氮化硼晶体的片状结构中没有自由电子;
(5)晶胞中Si原子数目为4、C原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,每个Si原子周围有4个碳原子,原子配位数与原子数目成反比,则碳原子配位数也是4,即碳原子周围与其距离最近的硅原子数目为4;
以顶点C原子研究,与之距离最近的C原子位于面心上,每个顶点原子为8个晶胞共用,每个面为2个晶胞共用,与碳原子等距离最近的碳原子有$\frac{8×3}{2}$=12个;
晶胞质量为4×$\frac{28+12}{{N}_{A}}$g,则晶体密度为4×$\frac{28+12}{{N}_{A}}$g÷(a×10-10 cm)3=$\frac{1.6×1{0}^{32}}{{a}^{3}×{N}_{A}}$g/cm3,
故答案为:4;12;$\frac{1.6×1{0}^{32}}{{a}^{3}×{N}_{A}}$.
点评 本题是对物质结构的考查,涉及电离能、核外电子排布、杂化轨道、分子结构、晶胞结构与计算等,注意根据有无自由电子分析六方相氮化硼晶体不导电,侧重考查学生分析能力、知识迁移运用能力,难度中等.

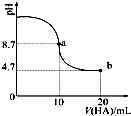 室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )| A. | a点所示溶液中c(HA)>c(A-) | |
| B. | 当加入HA溶液10ml时,$\frac{{K}_{W}}{c({H}^{+})}$<1.0×10-7mol•L-1 | |
| C. | a点所示溶液中c(Na+)=c(A-)+c(HA) | |
| D. | b点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) |
| A. | 2-甲基-3-乙基戊烷 | B. | 3,4,4-三甲基己烷 | ||
| C. | 2-甲基-4-乙基戊烷 | D. | 1,2-二甲基丁烷 |
| A. | CuSO4晶体 | B. | Cu(NO3)2晶体 | C. | CH3COOK固体 | D. | SO3固体 |
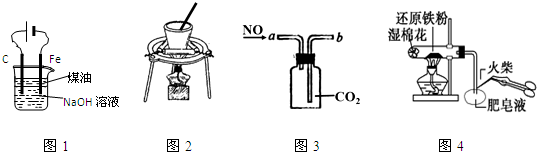
| A. | 图1:实验室制备Fe(OH)2 | |
| B. | 图2:从NaCl与I2的混合物中回收I2 | |
| C. | 图3:收集NO气体 | |
| D. | 图4:检验铁粉与水蒸气反应产生的氢气 |
| 原子序数 | 核外电子排布式 | 外围电子排布式 | 周期表中的位置 |
| 16 | 1S22S22P63S23P4 | 3s23p4 | 第三周期第ⅥA族 |
| 23 | 1S22S22P63S23P63d34s2 | 3d34s2 | 第四周期第ⅤB族 |
| 34 | 1S22S22P63S23P63d104s24p4 | 4s24p4 | 第四周期第ⅥA族 |