题目内容
14.氮、磷及其化合物广泛存在于自然界中,回答下列问题:(1)在基态16N中,其P能级的电子云轮廓是哑铃形,原子核外电子排布为1s22s22p3;
(2)碱性肥料氰氮化钙(CaCN2)的组成元素第一电离能最小的是Ca,CaCN2和H2O可发生如下反应:CaCN2+2H2O=NH4CN+Ca(OH)2,则NH4CN中含有5个δ键和2个π键.
(3)化合物(CH3)3N能溶于水,试解释其原因(CH3)3N与水分子间形成氢键,(CH3)3N与水均为极性分子,相似相溶,化合物(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键为配位键.
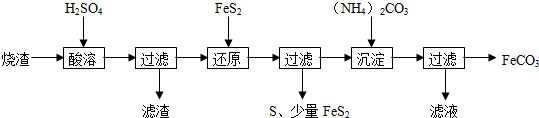
(4)阳离子[(CH3)3NH]+和阴离子A可按个数比4:1组成化合物,阴离子A的结构如图1所示:
则S原子以sp3杂化方式与Ge结合,阴离子A的化学式为[Ge4S10]4-.
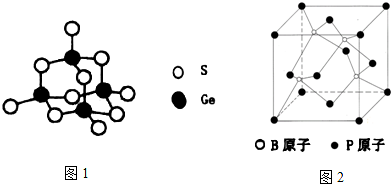
(5)BP是一种耐磨材料,其结构与金刚石相似(如图2),已知晶体中B与P原子的最近距离为apm,则该晶体密度的表达式为$\frac{4×42}{{N}_{A}×(\frac{4a}{\sqrt{3}}×1{0}^{-10})^{3}}$g•cm-3(不需化简).
分析 (1)P能级的电子云轮廓是哑铃形,N原子核外电子数为7,根据能量最低原理书写核外电子排布;
(2)金属性越强第一电离能越小;NH4+含有4个δ键,CN-中含有碳氮三键,含有1个δ键和2个π键;
(3)N元素电负性很大,能与水分子之间形成氢键,结合相似相溶原理分析;氢离子含有空轨道,N原子含有孤对电子,通过配位键生成[(CH3)3NH]+;
(4)阳离子[(CH3)3NH]+和阴离子A可按个数比4:1组成化合物,阴离子A中含有4个Ge和10个S,结合电中性可知阴离子为[Ge4S10]4-,结构中6个S原子形成2个共价键,还含有2个孤对电子,其中4个S只形成一个共价键,则还要得到一个电子才能形成8电子稳定结构,含有3对孤电子对,杂化轨道数目均为4;
(5)B原子与周围的4个P原子形成正四面体结构,B原子与晶胞顶点P原子连线处于晶胞体对角线上,且距离为体对角线长度的$\frac{1}{4}$,体对角线长度为晶胞棱长的$\sqrt{3}$倍,可以计算晶胞棱长,根据均摊法计算晶胞中原子数目,表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算晶体密度.
解答 解:(1)P能级的电子云轮廓是哑铃形,N原子核外电子数为7,核外电子排布式为1s22s22p3,
故答案为:哑铃;1s22s22p3;
(2)Ca为金属,C、N为非金属性,故Ca的第一电离能最小;NH4+含有4个δ键,CN-中含有碳氮三键,含有含有1个δ键和2个π键,故NH4CN中含有5个δ键和2个π键,
故答案为:Ca;5;2;
(3)极性分子(CH3)3N和水之间形成氢键,所以溶解性增强,且二者均为极性分子,相似相溶,
化合物(CH3)3N与盐酸反应生成[(CH3)3 NH]+,氢离子含有空轨道,N原子含有孤对电子,该过程新生成的化学键为氮与质子氢离子形成配位键,
故答案为:(CH3)3N与水分子间形成氢键,(CH3)3N与水均为极性分子,相似相溶;配位键;
(4)阳离子[(CH3)3NH]+和阴离子A可按个数比4:1组成化合物,阴离子A中含有4个Ge和10个S,结合电中性可知阴离子为[Ge4S10]4-,结构中6个S原子形成2个共价键,还含有2个孤对电子,其中4个S只形成一个共价键,则还要得到一个电子才能形成8电子稳定结构,含有3对孤电子对,杂化轨道数目均为4,属于sp3杂化;
故答案为:sp3;[Ge4S10]4-;
(5)B原子与周围的4个P原子形成正四面体结构,B原子与晶胞顶点P原子连线处于晶胞体对角线上,且距离为体对角线长度的$\frac{1}{4}$,体对角线长度为晶胞棱长的$\sqrt{3}$倍,晶体中B与P原子的最近距离为a pm,则晶胞棱长为$\frac{4a}{\sqrt{3}}$ pm,晶胞中B原子数目为4,P原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故晶胞质量为4×$\frac{11+31}{{N}_{A}}$g,则晶体密度为4×$\frac{11+31}{{N}_{A}}$g÷($\frac{4a}{\sqrt{3}}$×10-10 cm)3=$\frac{4×42}{{N}_{A}×(\frac{4a}{\sqrt{3}}×1{0}^{-10})^{3}}$g•cm-3,
故答案为:$\frac{4×42}{{N}_{A}×(\frac{4a}{\sqrt{3}}×1{0}^{-10})^{3}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、化学键、杂化方式、分子结构与性质、晶胞计算等,注意晶胞密度的计算利用均摊法、注意理解同周期主族元素中第一电离能异常原因,理解价层电子对理论与杂化轨道理论.

 纳米氧化亚铜在水的光解等领域具有极大应用潜能,是极具开发前景的绿色环保光催化剂.目前主要的合成方法有电解法、高温固相法等.
纳米氧化亚铜在水的光解等领域具有极大应用潜能,是极具开发前景的绿色环保光催化剂.目前主要的合成方法有电解法、高温固相法等.(1)有研究表明阳极氧化法成功制得了Cu2O 纳米阵列,装置如图:该电池的阳极反应方程式为2Cu-2e-+2OH-=Cu2O+H2O离子交换膜为阴(填阳或阴)离子交换膜,铜网应连接电源的正极.
(2)在高温下用甲烷将粉状CuO 还原也可制得Cu2O.
已知:①2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s);△H=-169kJ•mol-1
②CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-846.3kJ•mol-1
③Cu(s)+$\frac{1}{2}$O2(g)=CuO(s);△H=-157kJ•mol-1
则该反应的热化学方程式是:8CuO(s)+CH4(g)=4Cu2O(s)+CO2(g)+2H2O(g)△H=-266.3kJ/mol.
(3)在相同的密闭容器中,用等质量的三种纳米Cu2O(用不同方法制得)分别进行催化分解水的实验:2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H>0.水蒸气浓度随时间t变化如下表所示:
| 序号 |  | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
②实验①前20min的平均反应速率 v(O2)=3.5×10-5mol/(L•min)
③比较不同方法制得的Cu2O的催化效果应选用①和②组实验,原因是除催化剂外,其他条件相同.
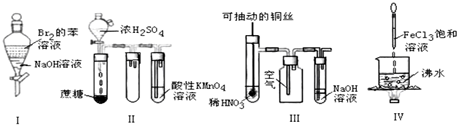
| A. | 实验Ⅰ:振荡后静置,上层溶液颜色保持不变 | |
| B. | 实验Ⅱ:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 | |
| C. | 实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. | 实验Ⅳ:向沸水中滴加FeCl3溶液,继续煮沸溶液至红褐色,就可以制备FeCl3胶体 |
已知25℃,部分物质的溶度积常数如下:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
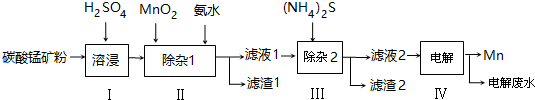
(2)步骤Ⅱ中,须加氨水调节溶液的pH为5.0~6.0,则滤渣1的主要成分为Fe(OH)3(填化学式).已知MnO2的作用为氧化剂,则得到该成分所涉及的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2OFe3++3NH3﹒H2O=Fe(OH)3↓+3NH4+.
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是若(NH4)2S的浓度过大,产生MnS沉淀,造成产品损失.
(4)滤液2中,c(Co2+):c(Ni2+)=5:1.
(5)将质量为a㎏的碳酸锰矿经上述流程处理后得到单质Mn b kg.若每一步都进行完全,滤渣1为纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为$\frac{(b-\frac{c}{107}×\frac{1}{2}×55)×\frac{115}{55}}{a}$×100%.(用含a、b、c的式子表达,无需化简)
| A. | CuSO4晶体 | B. | Cu(NO3)2晶体 | C. | CH3COOK固体 | D. | SO3固体 |
| A. | NH3 | B. | O2 | C. | H2O | D. | CO2 |