题目内容
15.某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其他电极均为Cu,则下列叙述中正确的是( )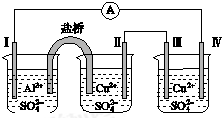
| A. | 电极Ⅰ发生还原反应 | B. | 电流方向:电极Ⅳ→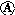 →电极Ⅰ →电极Ⅰ | ||
| C. | 电极Ⅱ逐渐溶解 | D. | 电极Ⅲ的电极反应:Cu2++2e-═Cu |
分析 电极Ⅰ为Al,其它均为Cu,Al易失电子作负极,所以Ⅰ是负极、Ⅳ是阴极,Ⅲ是阳极、Ⅱ是正极,电流方向从正极流向负极,负极上失电子发生氧化反应,正极上得电子发生还原反应,阳极上失电子发生氧化反应,阴极上得电子发生还原反应,据此分析解答.
解答 解:电极Ⅰ为Al,其它均为Cu,Al易失电子作负极,所以Ⅰ是负极、Ⅳ是阴极,Ⅲ是阳极、Ⅱ是正极,
A.电极Ⅰ上电极反应式为Al-3e-=Al3+,发生氧化反应,故A错误;
B.电流方向从正极流向阳极,阴极流向负极,即电极Ⅳ→A→电极Ⅰ,故B正确;
C.电极Ⅱ是正极,正极上发生反应为Cu 2++2e-=Cu,所以电极Ⅱ质量逐渐增大,故C错误;
D.电极Ⅲ为阳极,电极反应式为Cu-2e-═Cu 2+,故D错误;
故选B.
点评 本题考查了原电池原理,正确判断正负极是解本题关键,再结合各个电极上发生的反应来分析解答,题目难度中等.

练习册系列答案
相关题目
5.如图实验现象预测正确的是( )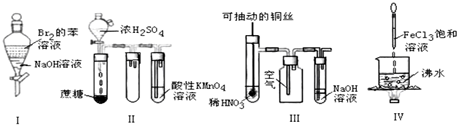

| A. | 实验Ⅰ:振荡后静置,上层溶液颜色保持不变 | |
| B. | 实验Ⅱ:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 | |
| C. | 实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. | 实验Ⅳ:向沸水中滴加FeCl3溶液,继续煮沸溶液至红褐色,就可以制备FeCl3胶体 |
3.过量的Fe与一定量的稀硫酸反应制取氢气,一定温度下为加快反应速率而又不影响氢气的量,可向其中加入少量的( )
| A. | CuSO4晶体 | B. | Cu(NO3)2晶体 | C. | CH3COOK固体 | D. | SO3固体 |
10.下列叙述正确的是( )
| A. | 同一主族的元素,原子半径越大,其单质的熔点一定越高 | |
| B. | 只要含有金属阴离子的晶体就一定是离子晶体 | |
| C. | 第三周期元素的离子半径从左到右逐渐减小 | |
| D. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增强 |
20.用下列实验装置进行相应实验,不能达到实验目的( )

| A. | 图1:实验室制备Fe(OH)2 | |
| B. | 图2:从NaCl与I2的混合物中回收I2 | |
| C. | 图3:收集NO气体 | |
| D. | 图4:检验铁粉与水蒸气反应产生的氢气 |
4.加热试管中的NH4HCO3,使放出的气体依次通过盛有足量过氧化钠的干燥管、足量浓硫酸的洗气瓶,最后得到的气体是( )
| A. | NH3 | B. | O2 | C. | H2O | D. | CO2 |
5. 一定温度下,将1mol A和1mol B 气体充入2L恒容密闭容器中,发生反应A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确的是( )
一定温度下,将1mol A和1mol B 气体充入2L恒容密闭容器中,发生反应A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确的是( )
 一定温度下,将1mol A和1mol B 气体充入2L恒容密闭容器中,发生反应A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确的是( )
一定温度下,将1mol A和1mol B 气体充入2L恒容密闭容器中,发生反应A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确的是( )| A. | 反应方程式中的x=1 | |
| B. | t3时刻改变的条件是移去少量物质D | |
| C. | t2时刻改变的条件是使用催化剂 | |
| D. | t1~t3间该反应的平衡常数均为4 |
