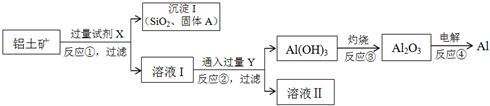
题目内容
1.关工业上以软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)的工艺流程如图1所示.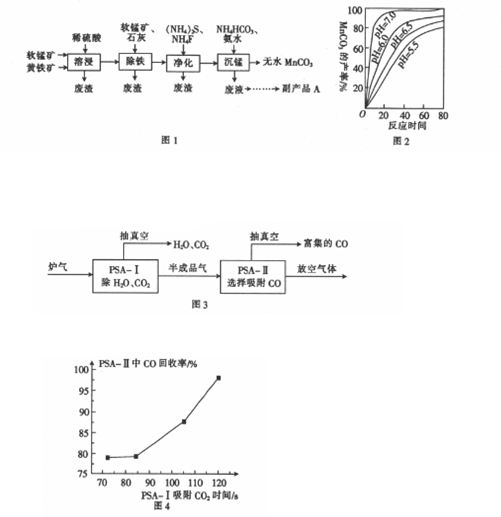
已知:MnCO3难溶于水、乙醇、潮湿时易被空气氧化,100℃时开始分解,回答下列问题:
(1)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质.若测得滤液中c(F-)=0.01mol•L-1,则滤液中残留的c(Ca2+)=1.46×10-6mol•L-1mol•L-1 [已知:Ksp(CaF2)=1.46×10-10]
(2)沉锰工序中,298K、c(Mn2+)=1.05mol•L-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如图2所示.根据图2中信息得出的结论是pH等于7.0时反应速率最快,且MnCO3的产率最高.
(3)从沉锰工序中得到纯净MnCO3的操作方法是过滤、先水洗2~3次,再用乙醇洗涤,低温干燥(或低于100℃干燥).
(4)MnCO3高温煅烧可得到软磁体Mn3O4,但分解生成的CO需要回收利用.到目前为止,CO吸附剂的开发大多数以铜(+1)为活性组分负载在各种载体上,然后采用变压器吸附(PSA)的方式在含N2体系中脱出CO.图3是变压吸附回收炉气中CO的流程.
①PSA-Ⅰ吸附CO2的时间对PSA-Ⅱ中CO回收率的影响如图4所示,由此可见,为了保证载铜吸附剂对CO的吸附和提纯要求,应采取的措施是尽量在PSA-I中将CO2脱除(保证PSA-I吸附CO2的时间).
②从PSA-Ⅱ中富集得到的CO有广泛的用途,除生产甲醇外,其用途还有作燃料(任写一种).
③检验放空气体中是否含有CO的实验操作是将该气体通入氯化钯(PdCl2)溶液中,观察是否有黑色的单质钯生成,写出对应的化学方程式:CO+PdCl2+H2O═Pd↓+2HCl+CO2.
(5)为测定某软锰矿中二氧化锰的质量分数,准确称量1.00g软锰矿样品,加入2.68g草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,将所得溶液转移到250mL容量瓶中用蒸馏水稀释至刻度线,从中取出25.0mL,用0.0200mol•L-1高锰酸钾溶液进行滴定,当滴入20.0mL溶液时恰好完全反应.
已知高锰酸钾、二氧化锰在酸性条件下均能将草酸钠(Na2C2O4)氧化,反应原理如下:
2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O
MnO2+C2O42-+4H+═Mn2++2CO2↑+2H2O
求该软锰矿中二氧化锰的质量分数87%.
分析 由流程可知软锰矿(主要成分MnO2)和黄铁矿加入硫酸酸浸过滤得到浸出液调节溶液pH,FeS2和稀硫酸反应生成Fe2+,然后过滤得到滤渣是MnO2,向滤液中加入软锰矿发生的离子反应方程式为:2Fe2++15MnO2+28H+=2Fe3++14H2O+15Mn2++4SO42,过滤,滤液中主要含有Cu2+、Ca2+等杂质,加入硫化铵和氟化铵,除去Cu2+、Ca2+过滤,在滤液中加入碳酸氢铵和氨水沉锰,生成MnCO3沉淀,过滤得到的滤渣中主要含有MnCO3,通过洗涤、烘干得到MnCO3晶体;
(1)由于流程第二步加入了石灰引入了Ca2+杂质,因此除去溶液中的Cu2+、Ca2+等杂质可分别使用(NH4)2S和NH4F,生成CuS、CaF沉淀除去,根据已知氟化钙的溶度积和c(F-),可求c(Ca2+);
(2)根据沉锰的图象可知,pH越大得到的MnCO3的产率越高,且需要的时间越短,且在pH=7时,有更好的效果;
(3)从沉锰工序中得到纯净MnCO3,只需将沉淀析出的MnCO3过滤、洗涤、干燥即可得到碳酸锰;
(4)①CO吸附剂的开发大多数以铜(+1)为活性组分负载在各种载体上,然后采用变压吸附(PSA)方式在含N2体系中脱出CO,图象方向可知时间越长CO回收率越高;
②一氧化碳是可燃性气体燃烧过程中放热;
③为了检测CO对空气的污染情况,常需用到氯化钯(PdCl2)溶液.将CO气体通入氯化钯(PdCl2)溶液中(水也参与反应),能产生黑色金属钯、CO2和一种酸.请写出该反应的化学反应方程式;
(5)n(C2O42-)=2.68g÷134g/mol=0.02mol;
滴定250mL稀释后溶液,消耗n(MnO4-)=0.0200mol/L×0.0200L×10=0.00400mol;
根据氧化还原反应中得失电子数相等得n(MnO2)×2+0.00400mol×5=0.0200mol×2,
n(MnO2)=0.0100mol,再根据质量分数公式计算其质量分数.
解答 解:由流程可知软锰矿(主要成分MnO2)和黄铁矿加入硫酸酸浸过滤得到浸出液调节溶液pH,FeS2和稀硫酸反应生成Fe2+,然后过滤得到滤渣是MnO2,向滤液中加入软锰矿发生的离子反应方程式为:2Fe2++15MnO2+28H+=2Fe3++14H2O+15Mn2++4SO42,过滤,滤液中主要含有Cu2+、Ca2+等杂质,加入硫化铵和氟化铵,除去Cu2+、Ca2+过滤,在滤液中加入碳酸氢铵和氨水沉锰,生成MnCO3沉淀,过滤得到的滤渣中主要含有MnCO3,通过洗涤、烘干得到MnCO3晶体;
(1)由于流程第二步加入了石灰引入了Ca2+杂质,因此除去溶液中的Cu2+、Ca2+等杂质可分别使用(NH4)2S和NH4F,生成CuS、CaF沉淀除去,根据已知氟化钙的溶度积和c(F-)可知:c(Ca2+)=$\frac{{K}_{sp}(Ca{F}_{2})}{{c}^{2}({F}^{-})}$=$\frac{1.46×1{0}^{-10}}{0.0{1}^{2}}$=1.46×10-6mol•L-1,故答案为:1.46×10-6mol•L-1;
(2)从沉锰的图象可以看出,在已给的几个pH值条件下,pH越大得到的MnCO3的产率越高,且需要的时间越短,且在pH=7时,有更好的效果,因此结论是pH等于7.0时反应速率最快,且MnCO3的产率最高,
故答案为:pH等于7.0时反应速率最快,且MnCO3的产率最高;
(3)从沉锰工序中得到纯净MnCO3,只需将沉淀析出的MnCO3过滤、先水洗2~3次,再用乙醇洗涤,低温干燥(或低于100℃干燥)即可;
故答案为:先水洗2~3次,再用乙醇洗涤,低温干燥(或低于100℃干燥);
(4)①CO吸附剂的开发大多数以铜(+1)为活性组分负载在各种载体上,然后采用变压吸附(PSA)方式在含N2体系中脱出CO,图象方向可知时间越长CO回收率越高,为了保证载铜吸附剂对CO的吸附和提纯要求,应采取的措施是尽量在PSA-I中将CO2 脱除(保证PSA-I吸附CO2的时间),
故答案为:尽量在PSA-I中将CO2 脱除(保证PSA-I吸附CO2的时间);
②一氧化碳是可燃性气体燃烧过程中放热,可以作为燃料,
故答案为:作燃料;
③CO气体通入氯化钯(PdCl2)溶液中(水也参与反应),能产生黑色金属钯、CO2和一种酸,由质量守恒定律,该酸为盐酸,反应的俄化学方程式为:CO+PdCl2+H2O═Pd+CO2+2HCl,
故答案为:CO+PdCl2+H2O═Pd↓+2HCl+CO2;
(5)n(C2O42-)=2.68g÷134g/mol=0.02mol,滴定250mL稀释后溶液,消耗n(MnO4-)=0.0200mol/L×0.0200L×10=0.00400mol,根据氧化还原反应中得失电子数相等得n(MnO2)×2+0.00400mol×5=0.0200mol×2,n(MnO2)=0.0100mol,二氧化锰质量分数=$\frac{0.0100mol×87g/mol}{1.00g}$×100%=87%,
故答案为:87%.
点评 本题通过碳酸锰的制备,考查了物质制备实验方案的设计方法,题目难度较大,明确制备流程及相应的反应原理为解答关键,试题涉及的知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学实验能力.

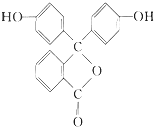
| A. | 酚酞具有弱酸性,且属于芳香烃 | |
| B. | 酚酞的分子式为C19H12O4 | |
| C. | 1mol酚酞最多与2molNaOH发生反应 | |
| D. | 酚酞在碱性条件下能够发生水解反应,呈现红色 |
| A. | 碳原子数≤10 的烷烃,其一氯代物没有同分异构体的烷烃共有3种 | |
| B. | 烯烃、炔烃、芳香烃都能与溴水反应而使其褪色 | |
| C. | 等质量的CH≡CH和C6H6完全燃烧时消耗等物质的量的氧气 | |
| D. | 分子式为C6H12与C3H6的两种烃一定互为同系物 |
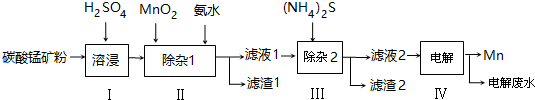
已知25℃,部分物质的溶度积常数如下:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(2)步骤Ⅱ中,须加氨水调节溶液的pH为5.0~6.0,则滤渣1的主要成分为Fe(OH)3(填化学式).已知MnO2的作用为氧化剂,则得到该成分所涉及的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2OFe3++3NH3﹒H2O=Fe(OH)3↓+3NH4+.
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是若(NH4)2S的浓度过大,产生MnS沉淀,造成产品损失.
(4)滤液2中,c(Co2+):c(Ni2+)=5:1.
(5)将质量为a㎏的碳酸锰矿经上述流程处理后得到单质Mn b kg.若每一步都进行完全,滤渣1为纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为$\frac{(b-\frac{c}{107}×\frac{1}{2}×55)×\frac{115}{55}}{a}$×100%.(用含a、b、c的式子表达,无需化简)
(1)第二周期中,元素的第一电离能处于B与N之间的元素有3种.
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为3d84s2.
(3)乙烯酮(CH2=C=O)是一种重要的有机中间体,可用CH3COOH在(C2H5O)3P=O存在下加热脱H2O得到.乙烯酮分子中碳原子杂化轨道类型是sp2和sp,1mol(C2H5O)3P=O分子中含有的σ键的数目为25NA.
(4)已知固态NH3、H2O、HF的氢键键能和结构如下:
| 物质 | 氢键X-H…Y | 键能kJ•mol-1 |
| (HF)n | D-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |
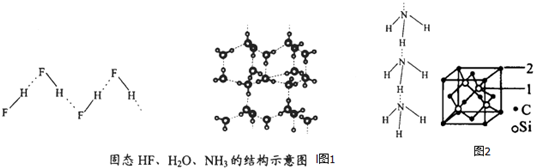
解释H2O、HF、NH3沸点依次降低的原因单个氢键的键能是(HF)n>冰>(NH3)n,而平均每个分子含氢键数:冰中2个,(HF)n和(NH3)n只有1个,气化要克服的氢键的总键能是冰>(HF)n>(NH3)n.
(5)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能.碳化硅晶胞结构中每个碳原子周围与其距离最近的硅原子有4个,与碳原子等距离最近的碳原子有12个.已知碳化硅晶胞边长为apm,则晶胞图中1号硅原子和2号碳原子之间的距离为$\frac{\sqrt{11}a}{4}$pm,碳化硅的密度为$\frac{1.6×1{0}^{32}}{{a}^{3}×{N}_{A}}$g/cm3.
| A. | 同一主族的元素,原子半径越大,其单质的熔点一定越高 | |
| B. | 只要含有金属阴离子的晶体就一定是离子晶体 | |
| C. | 第三周期元素的离子半径从左到右逐渐减小 | |
| D. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增强 |
| A. | SiO2和 SO2 | B. | CO2和 H2O | C. | NaCl 和 HCl | D. | CCl4和 KCl |