题目内容
1.恒温下,在容积为2升的甲、乙两个恒容密闭容器中分别充入H2和I2发生可逆反应:H2 (g)+I2(g) 2HI(g)△H=-Q kJ/mol,实验时有关数据如表:| 容器编号 | 起始物质的量mol | 4分钟后平衡时的物质量mol | 平衡时放出的热量/KJ | |
| I2 | H2 | HI | ||
| 甲 | 0.01 | 0.01 | 0.004 | Q1 |
| 乙 | 0.02 | 0.02 | a | Q2 |
| A. | 甲容器中,4分钟内氢气的反应速率为5.0×10-4rmol/(L•min) | |
| B. | 平衡时,放出的热量:Q1=4.0×10-3Q kJ | |
| C. | 平衡后,a=8.0×10-3mol,故乙中HI的质量分数比甲中高 | |
| D. | 该温度下,该反应的平衡常数K=0.25 |
分析 甲中平衡时HI的浓度为0.004mol,则:
H2(g)+I2(g)?2HI(g)△H=-14.9kJ/mol
开始(mol):0.01 0.01 0
变化(mol):0.002 0.002 0.004
平衡(mol):0.008 0.008 0.004
乙中I2、H2为甲的2倍,因反应前后气体的计量数之和相等,则增大压强平衡不一定,甲、乙平衡状态相同,以此解答该题.
解答 解:甲中平衡时HI的浓度为0.004mol,则:
H2(g)+I2(g)?2HI(g)△H=-14.9kJ/mol
开始(mol):0.01 0.01 0
变化(mol):0.002 0.002 0.004
平衡(mol):0.008 0.008 0.004
A.甲容器中,4分钟内氢气的反应速率为$\frac{\frac{0.002mol}{2L}}{4min}$=2.5.0×10-4 mol•L-1•min-1,故A错误;
B.平衡时,放出的热量为:Q1=0.002mol×QkJ•mol-1=2.0×10-3Q kJ,故B错误;
C.甲、乙平衡状态相同,则各物质的含量也相同,故C错误;
D.该温度下,该反应的平衡常数K=$\frac{(\frac{0.004}{2})^{2}}{\frac{0.008}{2}×\frac{0.008}{2}}$=0.25,故D正确.
故选D.
点评 本题考查等效平衡、化学平衡常数的计算等知识,为高频考点,侧重于学生的分析能力的考查,主要把握甲乙平衡状态的判断,难度中等,注意理解等效平衡规律.

 科学实验活动册系列答案
科学实验活动册系列答案| A. | 外观 | B. | 分散质粒子的大小 | ||
| C. | 是否能通过滤纸 | D. | 是否有丁达尔效应 |
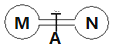 室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压),取下弹簧夹A,使两烧瓶内的气体充分接触(如图),容器内的压强由大到小的顺序是( )
室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压),取下弹簧夹A,使两烧瓶内的气体充分接触(如图),容器内的压强由大到小的顺序是( )| 编号 | ① | ② | ③ | ④ |
| 气体M | H2S | NH3 | HI | NO |
| 气体N | SO2 | HCl | Cl2 | O2 |
| A. | ③=④>①>② | B. | ③>④>①>② | C. | ④>③>②>① | D. | ④>③>①>② |
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(2)化学性质最不活泼的元素是Ar,其原子的原子结构示意图为
 ;
;(3)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;
(4)在③~⑦元素中,原子半径最大的是Na,原子半径最小的是Cl;
(5)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):2NaBr+Cl2=Br2+2NaCl.
| A. | 根据反应MnO4-+5Fe2++8H+=Mn2-+5Fe3++4H2O可知,用酸性KMnO4溶液可检验FeSO4•7H2O是否变质 | |
| B. | 用CO2鉴别NaAlO2溶液和CH3COONa溶液 | |
| C. | 用湿润的碘化钾淀粉试剂鉴别Br2(g)和NO2 | |
| D. | 用KOH溶液鉴别SO3(g)和SO2 |
| A. | NH4+ K+ Ca2+ NO3- | B. | K+ Al3+ Br- NO3- | ||
| C. | Ba2+ K+ SO42- NO3- | D. | H+ K+ SO42- Cl- |
 如图中的两条线分别代表的是:1g C3H6和1g M气体在相同容积的容器中,测得容器中的压强和温度的关系,试根据图形判断M气体的相对分子质量为( )
如图中的两条线分别代表的是:1g C3H6和1g M气体在相同容积的容器中,测得容器中的压强和温度的关系,试根据图形判断M气体的相对分子质量为( )