题目内容
15. 如图中的两条线分别代表的是:1g C3H6和1g M气体在相同容积的容器中,测得容器中的压强和温度的关系,试根据图形判断M气体的相对分子质量为( )
如图中的两条线分别代表的是:1g C3H6和1g M气体在相同容积的容器中,测得容器中的压强和温度的关系,试根据图形判断M气体的相对分子质量为( )| A. | 63 | B. | 28 | C. | 42 | D. | 无法计算 |
分析 由pV=nRT可知,在相同容积的容器中,若温度相同时,p与n成正比,由图可知,M的压强大,则M的物质的量大,以此来解答.
解答 解:由pV=nRT可知,在相同容积的容器中,若温度相同时,p与n成正比,
由图可知,M的压强大,设M的相对分子质量为x,
则$\frac{1.2}{0.8}$=$\frac{\frac{1}{x}}{\frac{1}{42}}$,
解得x=28,
故选B.
点评 本题考查阿伏伽德罗定律,明确图象的意义及温度相同时p与n成正比是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
10.对于反应2NO2(g)?N2O4(g)△H<0,在一定条件下达到平衡,欲使NO2转化率增大,应采取的措施是( )
①容器体积不变,再充入NO2
②容器体积不变,再充入N2O4
③使体积增大到原来的2倍
④升高温度.
①容器体积不变,再充入NO2
②容器体积不变,再充入N2O4
③使体积增大到原来的2倍
④升高温度.
| A. | ① | B. | ②③ | C. | ①② | D. | ③④ |
20.下列有关化学用语表示正确的是( )
| A. | 过氧化钠的电子式: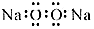 | B. | 次氯酸钠的结构式:H-Cl-OC | ||
| C. | 氯化铵的电子式: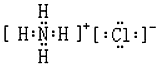 | D. | 硫离子的结构示意图: |
1.恒温下,在容积为2升的甲、乙两个恒容密闭容器中分别充入H2和I2发生可逆反应:H2 (g)+I2(g) 2HI(g)△H=-Q kJ/mol,实验时有关数据如表:
下列判断正确的( )
| 容器编号 | 起始物质的量mol | 4分钟后平衡时的物质量mol | 平衡时放出的热量/KJ | |
| I2 | H2 | HI | ||
| 甲 | 0.01 | 0.01 | 0.004 | Q1 |
| 乙 | 0.02 | 0.02 | a | Q2 |
| A. | 甲容器中,4分钟内氢气的反应速率为5.0×10-4rmol/(L•min) | |
| B. | 平衡时,放出的热量:Q1=4.0×10-3Q kJ | |
| C. | 平衡后,a=8.0×10-3mol,故乙中HI的质量分数比甲中高 | |
| D. | 该温度下,该反应的平衡常数K=0.25 |
18.在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
(已知N2(g)+3H2(g)=2NH3( g)△H=-92.4kJ•mol-1)
请写出下列物理量的关系:
(1)浓度c1与c2c1=c2 2c2与c32c2<c3
(2)能量a与ba+b=92.4 2b与c2b>c
(3)压强p1与p2p1=p2 2p2与p32p2>p3
(4)转化率α1与α2α1+α2=1 α2与α3α2>α3.
(已知N2(g)+3H2(g)=2NH3( g)△H=-92.4kJ•mol-1)
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| NH3的浓度(mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | α1 | α2 | α3 |
(1)浓度c1与c2c1=c2 2c2与c32c2<c3
(2)能量a与ba+b=92.4 2b与c2b>c
(3)压强p1与p2p1=p2 2p2与p32p2>p3
(4)转化率α1与α2α1+α2=1 α2与α3α2>α3.
19.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$.
(2)从表中看出,升高温度,K值增大,则CO2的转化率增大,化学反应速率增大.(以上均填“增大”“减小”或“不变”)
(3)能判断该反应是否达到化学平衡状态的依据是BC
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为830℃.
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$.
(2)从表中看出,升高温度,K值增大,则CO2的转化率增大,化学反应速率增大.(以上均填“增大”“减小”或“不变”)
(3)能判断该反应是否达到化学平衡状态的依据是BC
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为830℃.