题目内容
镍、钴、铈、铬虽然不是中学阶段常见的金属元素,但在工业生产中有着重要的作用.
(1)二氧化铈 (CeO2)是一种重要的稀土氧化物,在平板电视显示屏中有着重要的应用CeO2在稀硫酸和H2O2的作用下可生成Ce3+,H2O2在该反应中作 (填“氧化”“还原”)剂,每有1mol H2O2参加反应,转移电子的物质的量为 .
(2)某锂离子电池用含Li+导电固体为电解质.充电时,Li+还原为Li,并以原子形式嵌入电极材料碳(C6)中,以LiC6表示,电池反应为LiCoO2+C6
CoO2+LiC6,则放电时,电池的正极反应式为 ,如图甲表示该装置工作时电子和离子的移动方向,此时该电池处于 (填“放电”或“充电”)状态.
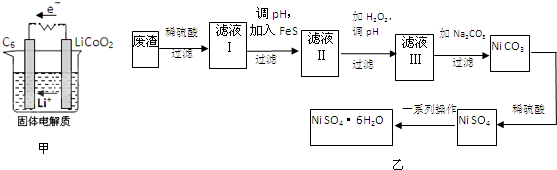
(3)NiSO4?6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe等元素)为原料获得.操作步骤如图乙:
①向滤液Ⅰ中加入FeS主要目的是除去Cu、Zn等杂质,除去Cu2+的离子方程式为 .
②向滤液Ⅱ中加入H2O2,溶液中发生反应的离子方程式为 ,调节pH的目的是 .
③滤液Ⅲ溶质的主要成分是NiSO4,再加入碳酸钠过滤后,加稀硫酸溶解又生成NiSO4的目的是 .
④我国第五套人民币中的一元硬币材料为钢芯镀镍,镀镍时,镍应作 极.
(1)二氧化铈 (CeO2)是一种重要的稀土氧化物,在平板电视显示屏中有着重要的应用CeO2在稀硫酸和H2O2的作用下可生成Ce3+,H2O2在该反应中作
(2)某锂离子电池用含Li+导电固体为电解质.充电时,Li+还原为Li,并以原子形式嵌入电极材料碳(C6)中,以LiC6表示,电池反应为LiCoO2+C6
| 充电 |
| 放电 |

(3)NiSO4?6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe等元素)为原料获得.操作步骤如图乙:
①向滤液Ⅰ中加入FeS主要目的是除去Cu、Zn等杂质,除去Cu2+的离子方程式为
②向滤液Ⅱ中加入H2O2,溶液中发生反应的离子方程式为
③滤液Ⅲ溶质的主要成分是NiSO4,再加入碳酸钠过滤后,加稀硫酸溶解又生成NiSO4的目的是
④我国第五套人民币中的一元硬币材料为钢芯镀镍,镀镍时,镍应作
考点:原电池和电解池的工作原理,氧化还原反应,制备实验方案的设计
专题:实验设计题,基本概念与基本理论
分析:(1)该反应中Ce元素化合价由+4价变为+3价,则CeO2作氧化剂,双氧水作还原剂,再结合元素化合价变化进行计算;
(2)放电时,正极上CoO2得电子和锂离子反应生成LiCoO2,根据电子流向及阳离子流向确定电极;
(3)①加入FeS,可转化为溶解度更小的难溶电解质;
②滤液Ⅱ中含有Fe2+,可与过氧化氢发生氧化还原反应生成Fe3+,调节pH,可有利于Fe3+的水解;
③从物质分离、提纯的角度思考;
④电镀时,镀层金属作阳极,镀件金属为阴极.
(2)放电时,正极上CoO2得电子和锂离子反应生成LiCoO2,根据电子流向及阳离子流向确定电极;
(3)①加入FeS,可转化为溶解度更小的难溶电解质;
②滤液Ⅱ中含有Fe2+,可与过氧化氢发生氧化还原反应生成Fe3+,调节pH,可有利于Fe3+的水解;
③从物质分离、提纯的角度思考;
④电镀时,镀层金属作阳极,镀件金属为阴极.
解答:
解:(1)该反应中Ce元素化合价由+4价变为+3价,则CeO2作氧化剂,双氧水作还原剂,每有1mol H2O2参加反应,转移电子的物质的量=1mol×2×(1-0)=2mol,
故答案为:还原;2mol;
(2)放电时,电池的正极发生还原反应,被CoO2还原生成LiCoO2,电极方程式为CoO2+Li++e-=LiCoO2,图1中电子向C6极移动,如C6为负极,则移向C6的离子应为阴离子,而移向C6的为阳离子,则C6应为阴极,此时该电池处于充电状态,
故答案为:CoO2+Li++e-=LiCoO2;充电;
(3)①向滤液Ⅰ中加入FeS主要目的是除去Cu、Zn等杂质,说明CuS的溶解度更小,反应的离子方程式为FeS(aq)+Cu2+(aq)=Fe2+(aq)+CuS(aq),
故答案为:FeS(aq)+Cu2+(aq)=Fe2+(aq)+CuS(aq);
②双氧水(H2O2)是强氧化剂,在酸性条件下氧化Fe2+生成Fe3+,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,调节溶液pH,则使Fe3+水解生成氢氧化铁沉淀,以除去Fe3+,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;使Fe3+水解生成氢氧化铁沉淀,以除去Fe3+;
③滤液Ⅲ溶质的主要成分是NiSO4,再加入碳酸钠过滤后,加稀硫酸溶解又生成NiSO4,可增大成NiSO4浓度,有利于蒸发结晶,故答案为:增大成NiSO4浓度,有利于蒸发结晶;
④镀镍时,镍应作阳极,故答案为:阳.
故答案为:还原;2mol;
(2)放电时,电池的正极发生还原反应,被CoO2还原生成LiCoO2,电极方程式为CoO2+Li++e-=LiCoO2,图1中电子向C6极移动,如C6为负极,则移向C6的离子应为阴离子,而移向C6的为阳离子,则C6应为阴极,此时该电池处于充电状态,
故答案为:CoO2+Li++e-=LiCoO2;充电;
(3)①向滤液Ⅰ中加入FeS主要目的是除去Cu、Zn等杂质,说明CuS的溶解度更小,反应的离子方程式为FeS(aq)+Cu2+(aq)=Fe2+(aq)+CuS(aq),
故答案为:FeS(aq)+Cu2+(aq)=Fe2+(aq)+CuS(aq);
②双氧水(H2O2)是强氧化剂,在酸性条件下氧化Fe2+生成Fe3+,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,调节溶液pH,则使Fe3+水解生成氢氧化铁沉淀,以除去Fe3+,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;使Fe3+水解生成氢氧化铁沉淀,以除去Fe3+;
③滤液Ⅲ溶质的主要成分是NiSO4,再加入碳酸钠过滤后,加稀硫酸溶解又生成NiSO4,可增大成NiSO4浓度,有利于蒸发结晶,故答案为:增大成NiSO4浓度,有利于蒸发结晶;
④镀镍时,镍应作阳极,故答案为:阳.
点评:本题考查较综合,涉及原电池和电解池原理、氧化还原反应、物质的分离和提纯等知识点,为考试热点,明确物质的性质是解本题关键,再结合基本原理、物质的性质分析解答,同时考查学生分析问题及实验基本操作能力,题目难度中等.

练习册系列答案
相关题目