题目内容
在体积为2L密闭容器中加入反应物A、B,发生如下反应:A+2B=3C.经2min后,A的浓度从开始时的1.0mol?L-1 降到0.8mol?L-1.已知反应开始时B的浓度是1.2mol?L-1.则:2min末B的浓度 ,C的物质的量 .2min内,用A物质的浓度变化来表示该反应的反应速率,即V(A)= .
考点:化学反应速率和化学计量数的关系
专题:化学反应速率专题
分析:计算2min内△c(A),利用浓度变化量之比等于化学计量数之比计算△c(B),2min末B的浓度=B的起始浓度-△c(B),利用浓度变化量之比等于化学计量数之比计算△c(C),根据n=cV计算C的物质的量,根据v=
计算v(A).
| △c |
| △t |
解答:
解:2min内△c(A)=1mol/L-0.8mol/L=0.2mol/L,
浓度变化量之比等于化学计量数之比,则△c(B)=2△c(A)=2×0.2mol/L=0.4mol/L,故2min末B的浓度=1.2mol/L-0.4mol/L=0.8mol/L,
浓度变化量之比等于化学计量数之比,则△c(C)=3△c(A)=3×0.2mol/L=0.6mol/L,故2min末C的物质的量=0.6mol/L×2L=1.2mol,
2min内,用A物质的浓度变化来表示该反应的反应速率,v(A)=
=0.1mol/(L.min),
故答案为:0.8mol/L;1.2mol;0.1mol/(L.min).
浓度变化量之比等于化学计量数之比,则△c(B)=2△c(A)=2×0.2mol/L=0.4mol/L,故2min末B的浓度=1.2mol/L-0.4mol/L=0.8mol/L,
浓度变化量之比等于化学计量数之比,则△c(C)=3△c(A)=3×0.2mol/L=0.6mol/L,故2min末C的物质的量=0.6mol/L×2L=1.2mol,
2min内,用A物质的浓度变化来表示该反应的反应速率,v(A)=
| 0.2mol/L |
| 2min |
故答案为:0.8mol/L;1.2mol;0.1mol/(L.min).
点评:本题考查化学反应速率的有关计算,常用定义法及化学反应速率规律进行计算,比较基础.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目

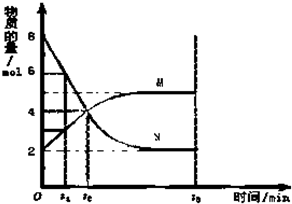 在一定温度下,在容积为2L的容器内,某反应各物质(均为气体)的物质的量随反应时间的变化曲线如图,试回答下列问题:
在一定温度下,在容积为2L的容器内,某反应各物质(均为气体)的物质的量随反应时间的变化曲线如图,试回答下列问题: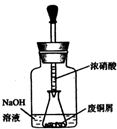 碱式碳酸铜 Cu2(OH)2CO3是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
碱式碳酸铜 Cu2(OH)2CO3是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下: