题目内容
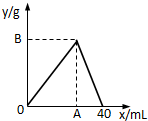 如图是表示往50mL AlCl3溶液中滴加4mol?L-1的NaOH溶液,生成沉淀的质量(y轴)与消耗NaOH溶液的体积(x轴)的关系.填空:
如图是表示往50mL AlCl3溶液中滴加4mol?L-1的NaOH溶液,生成沉淀的质量(y轴)与消耗NaOH溶液的体积(x轴)的关系.填空:(1)A点表示
(2)原c(AlCl3)=
(3)在B点处,生成
(4)若生成1.56g沉淀,则需要加入
考点:化学方程式的有关计算,镁、铝的重要化合物
专题:
分析:(1)向AlCl3溶液中滴加4mol?L-1的NaOH溶液发生的反应为AlCl3+3NaOH=Al(OH)3↓+3NaCl、Al(OH)3+NaOH=NaAlO2+2H2O,根据方程式知,生成沉淀最大量和沉淀完全溶解时消耗NaOH的体积之比为3:1,据此计算NaOH溶液体积;
(2)根据氯化铝和NaOH之间的关系式计算c(AlCl3);
(3)根据Al原子守恒计算氢氧化铝的物质的量,再根据m=nM计算其质量;
(4)先判断1.56g沉淀与铝离子完全沉淀时固体质量相对大小判断NaOH是否过量,再结合原子守恒解答.
(2)根据氯化铝和NaOH之间的关系式计算c(AlCl3);
(3)根据Al原子守恒计算氢氧化铝的物质的量,再根据m=nM计算其质量;
(4)先判断1.56g沉淀与铝离子完全沉淀时固体质量相对大小判断NaOH是否过量,再结合原子守恒解答.
解答:
解:(1)向AlCl3溶液中滴加4mol?L-1的NaOH溶液发生的反应为AlCl3+3NaOH=Al(OH)3↓+3NaCl、Al(OH)3+NaOH=NaAlO2+2H2O,根据图象知,A点表示铝离子完全转化为沉淀,根据方程式知,生成沉淀最大量和沉淀完全溶解时消耗NaOH的体积之比为3:1,所以NaOH溶液体积=
×40mL=30mL,
故答案为:铝离子完全转化为沉淀;30;
(2)A点时,根据AlCl3+3NaOH=Al(OH)3↓+3NaCl得AlCl3---3NaOH,
设氯化铝的物质的量浓度为xmol/L,
AlCl3---3NaOH
1mol 3mol
0.05xmol (0.03×4)mol
1mol:3mol=0.05xmol:(0.03×4)mol
x=
=0.8,
故答案为:0.8;
(3)根据Al原子守恒得n[Al(OH)3]=n(AlCl3)=0.8mol/L×0.05L=0.04mol,氢氧化铝质量m=nM=0.04mol×78g/mol=3.12g,
故答案为:3.12;
(4)若生成1.56g沉淀小于3.12g,所以有两种情况,一种情况是NaOH不足量,一种情况是NaOH过量,1.56g氢氧化铝的物质的量=
=0.02mol,
①当NaOH不足量时,根据氢氧根离子守恒得n[Al(OH)3]=3n(NaOH)=0.02mol×3=0.06mol,则V(NaOH)=
=15mL;
②当NaOH过量时,根据氢氧根离子守恒得剩余沉淀需要氢氧化钠的体积与①相同,为15mL;
根据铝原子守恒得溶解n[Al(OH)3]=0.04mol-0.02mol=0.02mol,溶解的氢氧化铝由氯化铝最终生成偏铝酸钠需要n(NaOH)=4n(AlCl3)=4×0.02mol=0.08mol,V(NaOH)=
=20mL,
总消耗NaOH体积=15mL+20mL=35mL,
故答案为:15或35.
| 3 |
| 4 |
故答案为:铝离子完全转化为沉淀;30;
(2)A点时,根据AlCl3+3NaOH=Al(OH)3↓+3NaCl得AlCl3---3NaOH,
设氯化铝的物质的量浓度为xmol/L,
AlCl3---3NaOH
1mol 3mol
0.05xmol (0.03×4)mol
1mol:3mol=0.05xmol:(0.03×4)mol
x=
| (0.03×4)mol×1mol |
| 3mol×0.05mol |
故答案为:0.8;
(3)根据Al原子守恒得n[Al(OH)3]=n(AlCl3)=0.8mol/L×0.05L=0.04mol,氢氧化铝质量m=nM=0.04mol×78g/mol=3.12g,
故答案为:3.12;
(4)若生成1.56g沉淀小于3.12g,所以有两种情况,一种情况是NaOH不足量,一种情况是NaOH过量,1.56g氢氧化铝的物质的量=
| 1.56g |
| 78g/mol |
①当NaOH不足量时,根据氢氧根离子守恒得n[Al(OH)3]=3n(NaOH)=0.02mol×3=0.06mol,则V(NaOH)=
| 0.06mol |
| 4mol/L |
②当NaOH过量时,根据氢氧根离子守恒得剩余沉淀需要氢氧化钠的体积与①相同,为15mL;
根据铝原子守恒得溶解n[Al(OH)3]=0.04mol-0.02mol=0.02mol,溶解的氢氧化铝由氯化铝最终生成偏铝酸钠需要n(NaOH)=4n(AlCl3)=4×0.02mol=0.08mol,V(NaOH)=
| 0.08mol |
| 4mol/L |
总消耗NaOH体积=15mL+20mL=35mL,
故答案为:15或35.
点评:本题考查化学方程式的计算,明确物质发生的反应是解本题关键,知道图中各个点对应溶液中的溶质,注意利用原子守恒解答,注意(4)要考虑过量计算,为易错点.

练习册系列答案
相关题目
实验室中电解饱和氯化钠溶液时,不能直接得到的物质是( )
| A、氯气 | B、氢气 |
| C、氢氧化钠 | D、氯化氢 |
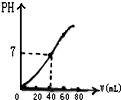 用1.0mol?L-1NaOH溶液中和某浓度H2SO4溶液,其PH和所用NaOH溶液的体积关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )
用1.0mol?L-1NaOH溶液中和某浓度H2SO4溶液,其PH和所用NaOH溶液的体积关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )| A、1.0mol?L-1、60mL |
| B、0.5mol?L-1、80mL |
| C、0.5mol?L-1、40mL |
| D、1.0mol?L-1、80mL |
下列各组试剂中,只用试管和胶头滴管,不用其他试剂就可以鉴别的是( )
| A、CaCl2溶液和Na2CO3溶液 |
| B、稀盐酸和AgNO3溶液 |
| C、NaOH溶液和Al2(SO4)3溶液 |
| D、Ba(OH)2溶液和Na2SO4溶液 |
下列关于实验现象的描述不正确的是( )
| A、把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 |
| B、用铜片做阳极,铁片做阴极,电解氯化铜溶液,铁片表面出现一层铜 |
| C、用铜作阳极,电解FeCl3溶液,在阴极上可析出铜 |
| D、把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
以下涉及H2O2的反应(未配平)中,H2O2仅表现出氧化性的是( )
| A、Ag2O+H2O2═Ag+O2↑+H2O |
| B、H2O2═H2O+O2↑ |
| C、H2O2+Cr2(SO4)3+KOH═K2CrO4+K2SO4+H2O |
| D、Na2O2+HCl═H2O2+NaCl |

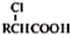 ,写出以苯酚、乙醇和乙酸为原料制备
,写出以苯酚、乙醇和乙酸为原料制备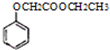 的合成路线流程图(无机试剂任用).合成路线流程图例如下:
的合成路线流程图(无机试剂任用).合成路线流程图例如下: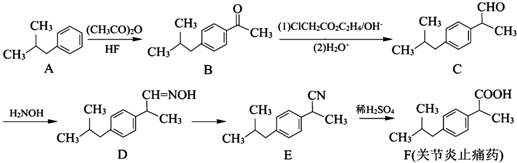
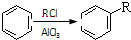 ②
②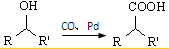 (R、R′表示烃基)
(R、R′表示烃基)