题目内容
7.对于可逆反应:N2(g)+3H2(g)?2NH3(g).下列判断不正确的是( )| A. | 20s内,H2的浓度改变0.60mol/L,表明该反应达到平衡状态 | |
| B. | 当气体总压强不随时间改变时,表明该反应达到平衡状态 | |
| C. | 使用催化剂会影响达到平衡的时间 | |
| D. | 达到化学平衡状态时,正、逆反应速率都为0且不再发生变化 |
分析 达到反应平衡状态时,在一定条件下的可逆反应里,正反应速率和逆反应速率相等,但是不等于0,反应混合物中各组成成分的百分含量保持不变,该反应就达到平衡状态,据此分析解答.
解答 解:A、20s内,H2的浓度改变0.60mol/L,不能说明正逆反应速率相等,不是平衡的特征,不能表明该反应达到平衡状态,故A错误;
B、反应前后气体系数和不等,所以当气体总压强不随时间改变时,表明该反应达到平衡状态,故B正确;
C、使用催化剂会加快反应速率,影响达到平衡的时间,故C正确;
D、达到化学平衡状态时,正、逆反应速率相等,但是都不为0,故D错误.
故选AD.
点评 本题考查化学平衡状态的判断,题目难度不大,明确只有当反应前后改变的物理量不变时,可逆反应才达到平衡状态.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
20.一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3═2HNO3+4N2+9H2O,在反应中还原产物与氧化产物的质量之比为( )
| A. | 5:3 | B. | 5:4 | C. | 1:1 | D. | 3:5 |
18.将甲气体同时通入过量的乙溶液中,一定能产生沉淀的组合是( )
| 序号 | 甲 | 乙 |
| ① | SO2 | 石灰水 |
| ② | CO2 | 石灰水 |
| ③ | SO2 | Ba(NO3)2 |
| ④ | NO2 | CaCl2 |
| A. | ②③④ | B. | ②③ | C. | ①③④ | D. | ①②③ |
2.元素性质呈周期性变化的根本原因是( )
| A. | 元素相对原子质量依次递增 | |
| B. | 元素的最高正化合价呈周期性变化 | |
| C. | 元素原子最外层电子排布呈周期性变化 | |
| D. | 元素金属性或非金属性呈周期性变化 |
19. 硫及其化合物对人类的生产和生活有着重要的作用.
硫及其化合物对人类的生产和生活有着重要的作用.
2SO2(g)+O2(g)?2SO3(g)△H=-198kJ•mol-1是制备硫酸的重要反应.
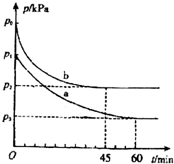
(1)在容积为V L的密闭容器中起始充入2mol SO2和1mol O2,反应在不同条件下进行,反应体系总压强随时间的变化如下图所示.与实验a相比,实验b改变的条件是升高温度,判断的依据实验b与a相比,反应速率快,平衡向逆反应方向移动.
(2)二氧化硫在一定条件下还可以发生如下反应:
SO2(g)+NO2(g)?SO3(g)+NO(g)△H=-42kJ•mol-1.
在1L恒容密闭容器中充入SO2(g)和NO2(g),所得实验数据如下:
①实验甲中,若2min时测得放出的热量是4.2kJ,则0~2min时间内,用SO2(g)表示的平均反应速率v(SO2)=0.05mol/(L.min),该温度下的平衡常数2.613.
②实验丙中,达到平衡时,NO2的转化率为$\frac{10a}{3}$×100%.
③由表中数据可推知,Tl<T2(填“>”“<’’或“=”),判断的理由是T1时,该反应的平衡常数K1=2.613,T2时,该反应的平衡常数K2=1,该反应正反应为放热反应,所以T1<T2.
 硫及其化合物对人类的生产和生活有着重要的作用.
硫及其化合物对人类的生产和生活有着重要的作用.2SO2(g)+O2(g)?2SO3(g)△H=-198kJ•mol-1是制备硫酸的重要反应.
(1)在容积为V L的密闭容器中起始充入2mol SO2和1mol O2,反应在不同条件下进行,反应体系总压强随时间的变化如下图所示.与实验a相比,实验b改变的条件是升高温度,判断的依据实验b与a相比,反应速率快,平衡向逆反应方向移动.
(2)二氧化硫在一定条件下还可以发生如下反应:
SO2(g)+NO2(g)?SO3(g)+NO(g)△H=-42kJ•mol-1.
在1L恒容密闭容器中充入SO2(g)和NO2(g),所得实验数据如下:
| 实验编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
| N(SO2) | N(NO2) | N(NO) | ||
| 甲 | T1 | 0.80 | 0.20 | 0.18 |
| 乙 | T2 | 0.20 | 0.80 | 0.16 |
| 丙 | T3 | 0.20 | 0.30 | a |
②实验丙中,达到平衡时,NO2的转化率为$\frac{10a}{3}$×100%.
③由表中数据可推知,Tl<T2(填“>”“<’’或“=”),判断的理由是T1时,该反应的平衡常数K1=2.613,T2时,该反应的平衡常数K2=1,该反应正反应为放热反应,所以T1<T2.
17.下列有关的叙述正确的是( )
| A. | 磷在氯气中燃烧产生大量的白烟,并放出热量 | |
| B. | 纯净的氢气在氯气中安静燃烧,发出黄色火焰 | |
| C. | 光照新制氯水有气泡逸出,该气体是Cl2 | |
| D. | 实验室制备氯气可用排饱和食盐水法收集 |