题目内容
2.元素性质呈周期性变化的根本原因是( )| A. | 元素相对原子质量依次递增 | |
| B. | 元素的最高正化合价呈周期性变化 | |
| C. | 元素原子最外层电子排布呈周期性变化 | |
| D. | 元素金属性或非金属性呈周期性变化 |
分析 元素的金属性和非金属性、元素的原子半径都属于元素的性质;元素的相对原子质量递增,但不呈现周期性的变化;结构决定性质,元素原子的核外电子排布的周期性变化导致元素性质的周期性变化.
解答 解:A、元素的原子的相对原子质量增大,但不呈现周期性的变化,则不能决定元素性质出现周期性变化,故A错误;
B、元素的最高正化合价的周期性变化是原子的电子排布周期性变化的结果,化合价属于元素的性质,故B错误;
C、由原子的电子排布可知,随原子序数的递增,电子层数和最外层电子数都呈现周期性的变化而引起元素性质的周期性变化,即原子的电子层排布的周期性变化是引起元素性质周期性变化的决定因素,故C正确;
D、元素金属性或非金属性都属于元素的性质,元素的金属性和非金属性的周期性变化是原子的电子排布周期性变化的结果,故D错误;
故选C.
点评 理解元素周期律的实质,元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果.

练习册系列答案
相关题目
15.辉铜矿是一种重要的铜矿石,主要含有硫化亚铜(Cu2S),还有Fe203、Si02及一些不溶性杂质.一种以辉铜矿石为原料制备硝酸铜晶体的工艺流程如下:
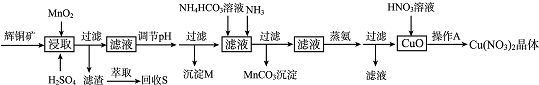
已知:部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol.L-1计算).
回答下列问题:
(1)浸取后得到的浸出液中含有CuSO4、MnSO4.写出浸取时产生CuSO4、MnSO4反应的化学方程式2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O.
(2)调节pH的目的是铁离子转化成氢氧化铁完全沉淀,pH的调节范围为3.2≤pH<4.4.
(3)生成MnC03沉淀的离子方程式为Mn2++NH3+HCO3-=MnCO3↓+NH4+.
(4)操作A为蒸发浓缩、冷却结晶.
(5)由辉铜矿制取铜的反应过程可以表示为:
2Cu2S(s)+302 (g)═2Cu20(s)+2SO2(g)△H=-768.2kJ.mol-l
2Cu20(s)+Cu2S(s)═6Cu(s)+S02(g)△H=+116.O kJ.mol-l
则由Cu2S与02加热反应生成Cu的热化学方程式为Cu2S(s)+02(g)═2Cu(s)+SO2(g)△H=-217.4kJ.mol-l.
(6)若用含85% Cu2S的辉铜矿来制备无水Cu(N03)2.假设浸取率为95%,调节pH时损失Cu 3%,蒸氨过程中有5%未转化为Cu0,其它过程中无损耗,则1.0kg这样的辉铜矿最多能制备1.75kg无水Cu(N03)2.

已知:部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol.L-1计算).
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
(1)浸取后得到的浸出液中含有CuSO4、MnSO4.写出浸取时产生CuSO4、MnSO4反应的化学方程式2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O.
(2)调节pH的目的是铁离子转化成氢氧化铁完全沉淀,pH的调节范围为3.2≤pH<4.4.
(3)生成MnC03沉淀的离子方程式为Mn2++NH3+HCO3-=MnCO3↓+NH4+.
(4)操作A为蒸发浓缩、冷却结晶.
(5)由辉铜矿制取铜的反应过程可以表示为:
2Cu2S(s)+302 (g)═2Cu20(s)+2SO2(g)△H=-768.2kJ.mol-l
2Cu20(s)+Cu2S(s)═6Cu(s)+S02(g)△H=+116.O kJ.mol-l
则由Cu2S与02加热反应生成Cu的热化学方程式为Cu2S(s)+02(g)═2Cu(s)+SO2(g)△H=-217.4kJ.mol-l.
(6)若用含85% Cu2S的辉铜矿来制备无水Cu(N03)2.假设浸取率为95%,调节pH时损失Cu 3%,蒸氨过程中有5%未转化为Cu0,其它过程中无损耗,则1.0kg这样的辉铜矿最多能制备1.75kg无水Cu(N03)2.
7.对于可逆反应:N2(g)+3H2(g)?2NH3(g).下列判断不正确的是( )
| A. | 20s内,H2的浓度改变0.60mol/L,表明该反应达到平衡状态 | |
| B. | 当气体总压强不随时间改变时,表明该反应达到平衡状态 | |
| C. | 使用催化剂会影响达到平衡的时间 | |
| D. | 达到化学平衡状态时,正、逆反应速率都为0且不再发生变化 |
14.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 高温下,16.8g Fe与足量水蒸气完全反应失去电子数为0.8 NA | |
| B. | 12g NaHSO4固体中阴离子所带负电荷数为0.02 NA | |
| C. | 1 mol OD-含有的质子、中子、电子数均为9NA | |
| D. | 含4 NA个离子的固体Na2O2溶于水配成1L溶液,所得溶液中c(Na+)=2 mol•L-1 |
12.根据相应的图象(图象编号与答案一一对应),判断下列相关说法正确的是( )
| A. | 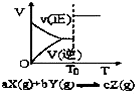 密闭容器中反应达到平衡,T0时改变某一条件有如图变化所示,则改变的条件一定是加入催化剂 | |
| B. | 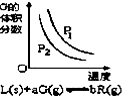 反应达到平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应,且a>b | |
| C. | 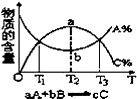 物质的百分含量和温度关系如图所示,则该反应的正反应为吸热反应 | |
| D. | 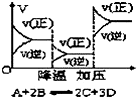 反应速率和反应条件变化关系如图所示,则该反应的正反应为放热反应,A、B、C是气体、D为固体或液体 |